УДК 621.785; 615.477
д.т.н., чл.-корр. РАЕ, профессор Родионов
И.В.
Саратовский государственный
технический университет имени Гагарина Ю.А., Россия
ИССЛЕДОВАНИЕ
ФУНКЦИОНАЛЬНЫХ Свойств И ХАРАКТЕРИСТИК МИКРОПОРИСТЫХ газотермических Оксидных
покрытий медицинского назначения
Статья подготовлена при финансовой поддержке гранта РФФИ «а» № 13-03-00248
Аннотация
Выполнены
экспериментальные исследования комплекса свойств функциональных металлооксидных
покрытий, получаемых на исходных шероховатых поверхностях медицинских
имплантатов из нержавеющей стали 12Х18Н9Т и титанового сплава ВТ16 способами
воздушно-термического и паротермического оксидирования. Испытаниями in vivo
установлено, что микропористые и морфологически гетерогенные термооксидные
покрытия способствуют эффективному интеграционному взаимодействию имплантатов с
костной тканью. Доказана принципиальная технологическая возможность получения и
медицинского применения биосовместимых оксидных покрытий на стальных и
титановых имплантатах при использовании различных реакционных окислительных
сред – воздуха и перегретого водяного пара соответственно.
Ключевые слова: имплантаты, нержавеющая сталь, титановый сплав,
микропористые оксидные покрытия, газотермическое оксидирование
The summary
Experimental
studies of the complex functional properties metal-oxide coatings obtained in
the initial rough surfaces of medical implants made of stainless
steel 12X18H9T and titanium alloy ВТ16 means of air
oxidation and thermal oxidation in an atmosphere superheated steam. In vivo
tests revealed that the morphologically heterogeneous and microporous
thermal-oxide coatings contribute to the effective interaction of the
integration implants with bone tissue. Proved in principle the possibility of
technological and medical applications of biocompatible oxide coatings on steel
and titanium implants using different reactive oxidizing environments – air and
superheated steam, respectively.
Keywords: implants, stainless steel, titanium alloy,
microporous oxide coatings, gas-thermal oxidation
Введение
В
настоящее время большой научно-практический интерес вызывают исследования физико-химических,
механических и биологических свойств ряда металлооксидных соединений для
получения биосовместимых покрытий, способных интегрироваться (срастаться) с
костной тканью. Этот новый вид функциональных медицинских покрытий может с высокой
эффективностью использоваться на различных технических системах и конструкциях
имплантационного назначения, выполняемых их разных металлов и сплавов и применяемых
в восстановительной медицине при лечении различных костных патологий опорно-двигательного аппарата и
челюстно-лицевого отдела.
Оксидные биосовместимые покрытия, создаваемые
на имплантатах различными методами термического оксидирования, защищают
металлическую основу от коррозионного воздействия сред организма (кровь, лимфа,
тканевая жидкость) благодаря электрохимическому защитному действию, существенно
понижая склонность имплантатов к коррозии [1]. Пассивированные, коррозионностойкие
имплантаты не вызывают длительных аллергических реакций организма, а также не
оказывают токсикологического действия на окружающие биоструктуры, что относится
к основным показателям биосовместимости имплантационных изделий. Данные
свойства характеризуют инертность системы «имплантат – оксидное покрытие» к
коррозионно-электрохимическому воздействию биожидкостей и во многом определяют
продолжительность стабильного функционирования как ортопедических, так и стоматологических
имплантатов.
Высокая прочность закрепления термооксидированных имплантатов в кости
может обеспечиваться за счет создания оксидных покрытий со способностью
эффективного физико-механического сцепления с прилегающей костью. Такая
способность обусловлена наличием у металлооксидных покрытий системы элементов
поверхности, характеризуемой выраженной шероховатостью и морфологической
гетерогенностью. Структурно-гетерогенная, микропористая поверхность покрытий
обеспечивает лучший контактный рост кости с более интенсивным протеканием
тканевых реакций в сравнении с поверхностью, имеющей гладкий, однородный
микрорельеф. Поэтому развитая оксидированная поверхность способствует,
во-первых, активному прорастанию костных клеточных структур в поры и углубления
оксидного слоя с протеканием процесса остеоинтеграции имплантатов, во-вторых –
направленной регенерации кости и ускоренному остеогенезу [2].
Указанные особенности металлооксидных покрытий
позволяют окружающим биоструктурам успешно адаптироваться к вживляемым
имплантационным системам без протекания выраженных реакций отторжения.
Важной и актуальной проблемой эффективного применения термически оксидированных металлических имплантатов в челюстно-лицевой хирургии, травматологии и ортопедии является обоснованный выбор оптимальных параметров поверхностной структуры металлооксидных покрытий для обеспечения их прочной взаимосвязи с окружающей костной тканью. Данная взаимосвязь может быть достигнута преимущественно за счет макро- и микроинтеграционного взаимодействия имплантируемых медико-технических конструкций с костью. При этом необходимо, чтобы сформированное на поверхности имплантатов металлооксидное биосовместимое покрытие обладало выраженной гетерогенной структурой с наличием большого количества открытых пор, размер которых должен обеспечивать нормальное проникновение костных клеток с последующим зарастанием всей поверхности костным регенератом. Так, для высокоэффективной остеоинтеграции медицинских имплантатов пористая структура оксидного слоя должна характеризоваться следующими параметрами: величиной суммарной открытой пористости на уровне 30-60%, размером пор – 20-200 мкм, глубиной пор – 10-100 мкм.
Микропористые биосовместимые поверхности стимулируют репаративный
остеогенез и обладают высокими остеокондуктивными свойствами. Наличие большого
количества открытых пор приводит к существенному возрастанию величины удельной
поверхности имплантатов, способствует адсорбции увеличенного количества
адгезивных белков, ускоряет миграционные клеточные механизмы и транспортные
биохимические системы, создавая оптимальные условия для образования новой костной
ткани [3-5].
В настоящее время термические металлооксидные
покрытия представляют большой практический интерес при их использовании на
стальных (12Х18Н9Т, 12Х18Н10Т) и титановых (ВТ1-0, ВТ1-00, ВТ6, ВТ16)
имплантатах. Формирование данных покрытий может осуществляться в
специализированных электронагревательных устройствах (электропечи
сопротивления, установки индукционного нагрева, печи паротермической обработки)
с применением различных реакционных окислительных сред, представляющих воздух,
перегретый водяной пар, смеси инертных и окисляющих газов [6-8].
Термическое
модифицирование поверхности имплантатов с помощью процессов оксидирования
позволяет придать им повышенные механические показатели за счет формирования на
поверхности тонкого слоя собственных оксидов металлов, входящих в химический
состав металлической основы. Образующиеся на поверхности металлооксидные соединения
в виде покрытия отличаются от металла основы повышенными механическими,
физическими и антикоррозионными характеристиками, а также способностью
длительное время сохранять свои функциональные свойства без разрушения
металлооксидной матрицы.
Наиболее распространенными способами термического оксидирования являются
воздушно-термическое и паротермическое оксидирование, предполагающие использование
в качестве реакционной технологической среды воздух и перегретый водяной пар
соответственно.
Поэтому целью работы
являлось исследование возможности получения на металлических имплантатах
микропористых воздушно-термических и паротермических оксидных покрытий, способных
срастаться с костной тканью.
Методика исследования и техника эксперимента
Образцами
являлись имплантаты-остеофиксаторы в виде винтовых стержней для чрескостного
остеосинтеза длиной 35 мм и диаметром 3 мм,
изготовленные путем токарной обработки прутков из нержавеющей стали 12Х18Н9Т (ГОСТ 5632-72) и титанового сплава
ВТ16 (ГОСТ
19807-74).
Подготовка
поверхности образцов перед термической обработкой проходила в несколько этапов,
включающих пескоструйную обработку корундовым абразивом для получения исходной
микрошероховатости, ультразвуковое обезжиривание в моющем растворе, промывку и
сушку (рис. 1).
Термическая обработка проводилась с
использованием двух способов: воздушно-термического и паротермического оксидирования.
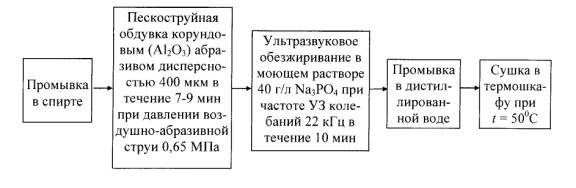
Рис. 1. Схема операций
предварительной обработки поверхности образцов
Воздушно-термическое
оксидирование проводилось для стальных образцов и осуществлялось в лабораторной
трубчатой электропечи сопротивления со свободным доступом воздуха в ее рабочий
объем. При
воздушно-термическом оксидировании применялись температуры обработки 400 и 5000С
с продолжительностью 0,5 ч при каждой температуре. Образование
покрытия происходило за счет взаимодействия стальной основы с кислородом
воздуха при определенной температуре в печи. В результате такого реакционного
взаимодействия на обрабатываемой поверхности формировались металлооксидные соединения,
которые придавали ей комплекс повышенных физико-химических и механических
свойств отличных от свойств основного металла. Происходило термическое
модифицирование поверхностных слоев образцов при сохранении химического состава
и свойств основной металлической матрицы. За счет термохимических процессов
фазообразования осуществлялось формирование на поверхности
воздушно-термического металлооксидного покрытия без использования дополнительных
материалов для получения покрытия.
Паротермическое оксидирование проводилось для титановых образцов в камерной электропечи экспериментальной нагревательной установки при температурах 550 и 6500С и выдержке 2 ч в атмосфере перегретого водяного пара. Паровая реакционная среда подавалась в камеру печи установки под давлением 1,2-1,3 атм, которое поддерживалось на протяжении всей продолжительности оксидирования. Получение термооксидных покрытий происходило в условиях взаимодействия поверхности титановых образцов с реакционными компонентами парогазовой среды, в результате чего формировались поверхностные металлооксидные системы определенной толщины и структуры.
К числу
наиболее важных характеристик исследуемых термооксидных покрытий относились
фазовый состав, толщина, шероховатость поверхности, пористость и морфология.
Определение фазового состава покрытий проводилось методом рентгенофазового
анализа с помощью дифрактометра ДРОН-4, снабженного рентгеновской трубкой с
медным анодом, в CuKα-излучении
при сканировании брэгговского угла со скоростью 2 град/мин. Идентификация фаз
на получаемых дифрактограммах осуществлялась с помощью данных картотек ASTM и JCPOS (1985 г.).
Толщина
получаемых покрытий определялась с помощью цифрового толщиномера типа TT230.
Шероховатость
поверхности формируемых покрытий исследовалась профилометрическим методом
измерения параметров микронеровностей Rа, Rmax, Sm
с применением микропроцессорного профилографа-профилометра «Калибр-117071».
Морфологические
характеристики термомодифицированной поверхности изучались методом
бесконтактного определения размерных параметров выступающих частиц и имеющихся
углублений, включая поры. Для таких измерений и обработки их результатов
использовался анализатор изображений микроструктур АГПМ-6М с микроскопом «Биолам»
и цифровой камерой Sony, а также специальная компьютерная программа, объединенные
в эффективный оптико-компьютерный комплекс, позволяющий бесконтактным методом
определять размерные параметры морфологии получаемых термооксидных покрытий.
Для выполнения экспериментально-клинических
испытаний термооксидированных стальных и титановых образцов использовались
лабораторные животные (кролики породы «серый великан»), которым в
большеберцовые кости на 50 суток устанавливались имплантаты. В период имплантации
выполнялись наблюдения за функционированием образцов в организме, проводились
лабораторные медико-биологические исследования. После удаления образцов с помощью
оптической микроскопии оценивалось влияние микропористой структуры их
воздушно-термических и паротермических
оксидных покрытий на характер взаимодействия с костной тканью.
Результаты исследования и их анализ
При исследовании характеристик термооксидированных поверхностей
стальных и титановых образцов было установлено, что покрытия на стали 12Х18Н9Т,
полученные способом воздушно-термического оксидирования, имеют, в основном,
четырехфазную структуру, включающую интерметаллид
FeNi, Fe, оксиды Ti2O3 и Fe2O3. Оксиды Cr и Ni присутствовали в покрытии в
весьма малых, «следовых» количествах, что, вероятнее всего, связано с высокой
жаростойкостью этих элементов, а также трудностью идентификации некоторых
слабоинтенсивных дифракционных линий при рентгенофазовом анализе. Покрытия на титановом
сплаве ВТ16, созданные паротермическим оксидированием, характеризовались
фазовым составом, включающим, в основном, нестехиометрический диоксид TiO2 с наличием весьма малого
содержания низших оксидов Ti2O3 и Ti3O5.
При профилометрическом исследовании и оптико-микроскопическом анализе
установлено, что рельеф и морфологическая структура поверхности покрытий
стальных и титановых образцов носят геометрически развитый характер, что
является следствием формирования термических металлооксидных слоев на
предварительно пескоструйно обработанных металлических поверхностях, имеющих
исходную выраженную микрошероховатость. Образование и рост покрытий на таких
микрошероховатых поверхностях происходит по принципу копирования профиля
рельефа исходной поверхности основы профилем рельефа получаемых оксидных
покрытий. В результате создается морфологически развитое шероховатое покрытие с
гетерогенной поверхностной структурой, имеющей многочисленные микронеровности,
включая открытые поры, углубления и частицы различного размера (рис. 2). Такая
структура термооксидированных поверхностей является благоприятной для
проникновения костных клеток в микронеровности, образованные частицами оксидов,
и может обеспечить эффективное взаимодействие медицинских имплантатов с
прилегающей костной тканью.
Так, величина суммарной открытой пористости у воздушно-термических оксидных
покрытий на стальных образцах достигала 34% при наибольшей температуре
обработки, у паротермических покрытий на титановых образцах она составляла 60%
при максимальном выбранном значении температуры оксидирования (табл.). При этом
шероховатость термооксидированной поверхности нержавеющей стали 12Х18Н9Т
характеризовалась несколько меньшими значениями параметров микронеровностей в
сравнении с термооксидированной поверхностью титанового сплава ВТ16, что
связано с разнотолщинностью покрытий, получаемых различными способами
оксидирования (табл.). При больших значения толщины металлооксидов, получаемых
при повышенных температурах и продолжительности термического модифицирования, в
покрытиях возникают значительные внутренние напряжения, из-за которых
происходит микрорастрескивание оксидных слоев и, как следствие, повышение
степени шероховатости и морфологической гетерогенности поверхности. Данное
явление образования микротрещиноватой и открытопористой структуры термооксидных
покрытий является благоприятным для эффективного физико-механического
взаимодействия поверхности оксидированных медицинских имплантатов с прилегающей
костной тканью и обеспечивает интеграционный тип связи в биотехнической системе
«имплантат с оксидным покрытием – кость».

Рис. 2. Гетерогенная
поверхностная структура газотермических покрытий, полученных на стальных (12Х18Н9Т)
и титановых (ВТ16) образцах различными способами оксидирования (х300): а – воздушно-термическое оксидирование
стальных образцов при t=4000С,
τ=0,5 ч; б – воздушно-термическое оксидирование стальных
образцов при t=5000С,
τ=0,5 ч; в – паротермическое оксидирование титановых образцов при t=5500С, τ=2 ч; г – паротермическое оксидирование
титановых образцов при t=6500С, τ=2
ч
Таблица
Характеристики
газотермических покрытий, полученных различными способами оксидирования имплантатов
|
Способ газотермического
оксидирования |
Материал имплантатов |
Режимы обработки |
Характеристики покрытий |
|||||||||
|
рсреды, атм |
t,
0С |
τ, ч |
фазовый состав |
толщина, мкм |
пористость, % |
размер
пор, мкм |
размер
частиц, мкм |
Шероховатость, мкм |
||||
|
Rа |
Rmax |
Sm |
||||||||||
|
Воздушно-термическое |
сталь 12Х18Н9Т |
норм. |
400-500 |
0,5 |
Fe, Fe2O3, FeNi, Ti2O3 |
25-40 |
29-34 |
28-30 |
15-20 |
1,1-1,4 |
5,6-5,8 |
~8 |
|
Паротермическое |
титановый сплав ВТ16 |
1,2-1,3 |
550- 650 |
2 |
TiO2, Ti2O3, Ti3O5 |
55-80 |
35-60 |
35-40 |
18-25 |
1,2-1,6 |
5,4-6,3 |
10-18 |
Путем проведения
испытаний in vivo на лабораторных животных
(кроликах) установлено, что стержневые титановые и стальные имплантаты без термического
оксидного покрытия (контрольная группа образцов) не проявили способность к
интеграционному взаимодействию с костной тканью по истечении 50 суток
клинического испытания. На поверхности таких имплантатов отсутствовал костный
регенерат, не происходило прочное соединение кости с металлической поверхностью
стержней без открытопористого шероховатого покрытия. Имплантаты контрольной
группы характеризовались низкой прочностью закрепления в костной ткани, с
течением времени подвергались расшатыванию с проявлением воспаления окружающих
тканей.
Термооксидные
покрытия с микропористой структурой, сформированные на стальных и титановых
образцах различными способами оксидирования, обеспечили в различной степени
выраженную интеграцию поверхности имплантатов с костной тканью. При использовании
стальных имплантатов с воздушно-термическим оксидным покрытием, полученным при t
= 4000С
и τ = 0,5 ч, наблюдалось
некоторое физико-механическое взаимодействие имплантатов с костью, о чем
свидетельствуют взаимосвязанные с покрытием костные фрагменты, выявленные на
поверхности имплантатов после их удаления из организма лабораторных животных
(рис. 3 а). Стальные имплантаты с воздушно-термическим оксидным
покрытием, созданным при повышенной температуре обработки, составляющей t
= 5000С,
проявили более высокую остеоинтеграционную способность, в результате которой на
поверхности образцов формировалось увеличенное количество новообразованной костной
ткани, прочно связанной с покрытием (рис. 3 б).
Титановые
имплантаты с паротермическими оксидными покрытиями вследствие их повышенной
степени шероховатости и открытой пористости способствовали присоединению к
поверхности значительного объема костного регенерата, что свидетельствует о
протекании на такой термомодифицированной поверхности интенсивного
костеобразования и о выраженной остеоинтеграционной способности применяемых
оксидных покрытий (рис. 3 в, г).
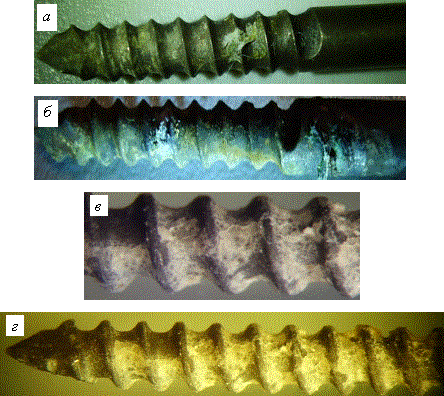
Рис. 3. Внешний вид винтовой
части опытных стержневых имплантатов с термооксидными покрытиями, полученными
различными способами оксидирования, после испытаний in vivo: а –
имплантат из стали 12Х18Н9Т с воздушно-термическим оксидным покрытием,
сформированным при t
= 4000С
и τ = 0,5 ч; б –
имплантат из стали 12Х18Н9Т с воздушно-термическим оксидным покрытием,
сформированным при t
= 5000С
и τ = 0,5 ч; имплантат из
титанового сплава ВТ16 с паротермическим оксидным покрытием, сформированным при t = 5500С и τ = 2 ч; имплантат из титанового
сплава ВТ16 с паротермическим оксидным покрытием, сформированным при t = 6500С и τ = 2 ч (на поверхности
термооксидированных имплантатов присутствует костный регенерат)
Таким образом,
наилучшую способность к интеграционному взаимодействию с костью проявили
покрытия стержневых титановых имплантатов, полученные способом паротермического
оксидирования при температурах 550 и 6500С с продолжительностью 2 ч.
Выводы
1.
Экспериментальными исследованиями свойств газотермических металлооксидных
покрытий, полученных на медицинских имплантатах из нержавеющей стали 12Х18Н9Т и
титанового сплава ВТ16, доказана возможность создания биосовместимых
остеоинтегрируемых поверхностей с выраженной микропористой структурой.
2.
Испытаниями in vivo установлено, что
воздушно-термические оксидные покрытия, полученные на имплантатах из
нержавеющей стали 12Х18Н9Т при t=4000С, 5000С с τ=0,5 ч, и
паротермические оксидные покрытия, сформированные на имплантатах из титанового
сплава ВТ16 при t=5500С, 6500С с τ=2 ч, способствуют
успешному приживлению медико-технических изделий в организме с высокоэффективным
взаимодействием оксидированных морфологически гетерогенных поверхностей с костной тканью.
Список использованной литературы
1. Родионов И.В. Коррозионные потенциалы различных видов поверхностей стальных ортопедических остеофиксаторов в физиологическом растворе // Коррозия: материалы, защита. №11, 2009. С. 6-10.
2. Родионов И.В.
Металлооксидные покрытия чрескостных имплантатов для остеосинтеза, обеспечивающие
микроостеоинтеграцию // Оралдың
ғылым жаршысы. №2 (38), 2012. С. 53-58.
3. Корж Н.А. Имплантационные материалы и
остеогенез. Роль биологической фиксации и остеоинтеграции в реконструкции кости
/ Н.А. Корж, Л.А. Кладченко, С.В. Малышкина и др. // Ортопедия, травматология и
протезирование. 2005. №4. С. 118-127.
4. Корж Н.А.
Имплантационные материалы и остеогенез. Роль индукции и кондукции в остеогенезе
/ Н.А. Корж, В.А. Радченко, Л.А. Кладченко, С.В. Малышкина // Ортопедия,
травматология и протезирование. 2003. №2. С. 150-157.
5. Хлусов
И.А. Генез костной ткани на поверхности имплантатов для остеосинтеза / И.А. Хлусов,
А.В. Карлов, И.В. Суходоло // Гений ортопедии. 2003. №3. С. 16-26.
6. Патент
РФ на изобретение № 2322267. Способ получения биосовместимого покрытия на
имплантатах из титана и его сплавов / Родионов И.В., Бутовский К.Г., Бейдик
О.В., Серянов Ю.В. Опубл. 20.04.2008.
7. Патент РФ на изобретение № 2332239. Способ
получения биосовместимого покрытия на остеофиксаторах из титана / Родионов
И.В., Бутовский К.Г., Бейдик О.В., Ткачева А.В. Опубл. 27.08.2008.
8. Патент РФ на изобретение
№2412723. Способ получения оксидного биосовместимого покрытия на чрескостных
имплантатах из нержавеющей стали / Родионов И.В., Бутовский К.Г., Анников В.В.,
Карпова А.И. Опубл. 27.02.2011.