Біологічні
науки/6. Мікробіологія
Рудик М.П.,
Позур В.В., Сківка Л.М., Сенчило Н.В., Позур В.К.
Київський
національний університет імені Тараса Шевченка, кафедра мікробіології та
загальної імунології, Україна
Вплив тейхоєвої
кислоти Staphylococcus aureus WOOD 46
на кисень-залежний метаболізм перитонеальних
макрофагів мишей в
нормі і при пухлинному рості
Бактерії та їх субклітинні компоненти вже близько 100 років
застосовуються в терапії хворих зі
злоякісними пухлинами, зокрема, в якості додаткових компонентів, що посилюють
імуногенність вакцинних препаратів. Однак, пошук бактеріальних адьювантів
триває, про що свідчать літературні дані.
Тейхоєві кислоти (ТК) – одні із основних компонентів клітинної стінки
грампозитивних мікроорганізмі. За
типом поліолу, що входить до складу полімеру, тейхоєві кислоти поділяють на
рибіттейхоєві та гліцеролтейхоєві кислоти. За останні роки найбільш широко
досліджено біологічну дію ТК, зв’язаних із гліколіпідом цитоплазматичної
мембрани, – ліпотейхоєвих кислот
(ЛТК). ЛТК є сильним ендотоксином, здатним викликати під час
бактеріальних інфекцій серйозні порушення в організмі та призводити до
септичного шоку [1,2,3]. Відомості стосовно імуномодулюючих властивостей
рибіттейхоєвих кислот, які використовувались нами, практично відсутні.
Здатність ТК спричиняти запальну імунну відповідь знаходить використання в
клінічній практиці при патологічних станах, лікування яких потребує
імунокорекції, в тому числі і при онкологічних патологіях. Метою роботи було,
дослідити вплив ТК S. aureus Wood 46 на
цитотоксичну активність перитонеальних мононуклеарів мишей в нормі та при
пухлинному рості.
Мононуклеарні фагоцити є однією і основних ланок протипухлинного імунітету.
Функціональна спрямованість макрофагів залежить від тканинного цитокінового мікрооточення. В умовах пухлинного росту макрофаги можуть
як перешкоджати, так і сприяти розвитку
злоякісного новоутворення. [4,5] До спектру метаболітів солідних пухлин входить ряд
сполук, що спричиняють альтернативну (толерогенну) активацію макрофагів. Така
активація перетворює їх на промотори пухлинного росту, зокрема, за рахунок
стимуляції неоангіогенезу в зоні розвитку злоякісного новоутворення.
Прозапальна активація макрофагів, спрямована в тому числі і на елімінацію
пухлинних клітин, супроводжується так званим „кисневим вибухом”, розвиток якого
може спричинити вплив деяких бактеріальних структур, зокрема ТК [6].
Дослідження проведені на мишах лінії
С57/Black, самицях віком 2-3 місяці, середньої ваги 24-26 г. Тейхоєву кислоту отримували із клітинних
стінок бактерій штаму Staphylococcus aureus Wood 46 за
методикою Арчібальда [7], шляхом обробки клітинних стінок 10% трихлороцтовою
кислотою. В якості експериментальної
пухлини використовували перещеплювану метастазуючу карциному легені Л′юїс
(3LL) у вигляді 20% клітинної суспензії. ТК вводили у дозах 0,5мкг/г, 2мкг/г,
1мкг/г, одночасно з
трансплантацією пухлинних клітин, в ділянку
крижового відділу. Інтактним тваринам ТК вводили аналогічним способом. Дослідження функціональної активності мононуклеарів мишей
проводились в НСТ-тесті [8] на момент
закінчення експерименту (35 доба після перещеплення експериментальної пухлини).
Цей період пухлинного росту характеризується метстазуванням карциноми легенів Л’юїс і загибеллю тварин.
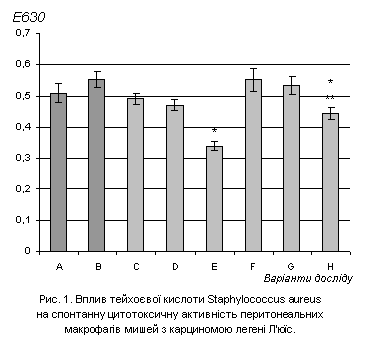
Як видно з рис. 1, у тварин, що отримали ТК в дозі 0,5мкг/г і 1,0мкг/г не
спостерігаються статистично достовірні зміни спонтанної цитотоксичної
активності. У мишей цієї групи макрофаги знаходяться в стані спокою. ТК в дозі 2мкг/г
обумовлювала зниження рівня спонтанного кисень-залежного метаболізму, що, можливо,
пояснюється токсичним впливом.
Рівень екзогенної (пірогенал) стимуляції цитотоксичної активності
макрофагів у тварин без пухлини, які отримали ТК в дозі 0,5мкг/г і 1 мкг/г, мав
значення близькі до контрольних (рис.2). При введенні ТК в дозі 2,0мкг/г,
спостерігалась відсутність реакції перитонеальних макрофагів на екзогенний
стимул, що свідчить про виснаження їх функціонального резерву. Причиною цього
може бути як пролонгована токсична дія ТК, так і тривалий запальний процес після
її введення.
Спонтанна цитотоксичність макрофагів у контрольних мишей пухлиноносіїв
знаходиться в межах значень для інтактних тварин. Введення ТК в дозах 0,5мкг/г,
1,0мкг/г не спричиняло статистично достовірних змін цього показника. ТК в дозі
2,0мкг/г обумовлювала зниження рівня кисень-залежного метаболізму макрофагів у
мишей з карциномою Л’юїс , хоча і меншою мірою, в порівнянні з інтактними тваринами.
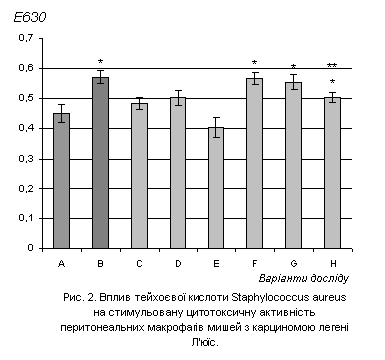 У мишей з пухлиною відповідь на стимуляцію
пірогеналом є значно вищою порівняно з контролем. При чому введення ТК не
змінює цей показник. У всіх групах мишей-пухлиноносіїв спостерігалось
підвищення функціонального резерву макрофагів до значень, вищих за контрольні.
Слід зазначити, що показники цитотоксичної активності макрофагів
характеризувались значною індивідуальною варіабельністю.
У мишей з пухлиною відповідь на стимуляцію
пірогеналом є значно вищою порівняно з контролем. При чому введення ТК не
змінює цей показник. У всіх групах мишей-пухлиноносіїв спостерігалось
підвищення функціонального резерву макрофагів до значень, вищих за контрольні.
Слід зазначити, що показники цитотоксичної активності макрофагів
характеризувались значною індивідуальною варіабельністю.
A –
контрольні інтактні тварини, n=5; E – тварини, що отримали ТК у дозі 2мкг/г, n=5;
B –
контрольні тварини-пухлиноносії, n=5; F – тварини-пухлиноносії, що отримали ТК у дозі 0,5мкг/г, n=5;
С
– тварини, що отримали ТК у дозі 0,5мкг/г,
n=5; H– тварини-пухлиноносії, що отримали ТК у дозі 1мкг/г, n=5;
D –
тварини, що отримали ТК у дозі 1мкг/г, n=5; G – тварини-пухлиноносії, що отримали ТК у дозі 2мкг/г, n=5;
Примітка: * - P<0,05 в порівнянні з
контрольними здоровими тваринами;
** - P<0,05 в порівнянні з контрольними
тваринами-пухлиноносіями
Отже, ТК, особливо у високій дозі знижує показники цитотоксичної активності
перитонеальних макрофагів мишей, ймовірно за рахунок токсичної дії препарату.
Хоча при пухлинному рості це проявляється меншою мірою, оскільки пухлинний
ріст, а особливо процеси некротизації, є потужними стимуляторами
кисень-залежного метаболізму макрофагів.
Література:
1. 1.Bhakdi, S., T. Klonisch, P. Nuber, and W. Fischer. Stimulation of monokine production by
lipoteichoic acids// Infect. Immun. – 1991. – Vol.59. –
P.4614-4620.
2. Gao J.J., Xue Q.,. Zuvanich E.G,.
Haghi K.R,
Morrison D.C Commercial
preparations of lipoteichoic acid contain endotoxin
that contributes to activation of mouse macrophages
in vitro // Infect. Immun. – 2001. – Vol. 69, N 2. –
P.751-757.
3. Levels J.H.M., Abraham P.R., van
Barreveld E.P., Meijers J.C.M., van Deventer S.J.H. Distribution
and kinetics of lipoprotein-bound lipoteichoic acid // Infect. Immun. – 2003. –
Vol.71(6). - P.3280-3284.
4. Coussens L.M., Werb Z. Inflammation and cancer
// Nature. – 2002.
– 420(19). – P. 860-67.
5. Ohno S., Suzuki N., Ohno Y., Inagawa H., Soma G., Inoue M. Tumor-associated
macrophages: foe or accomplice of tumors? // Anticancer Res. – 2003. – 23(6a).
– P. 4395-409.
6. Lotz S.,
Aga E., Wilde I., van Zandbergen G.,
Hartung T., Solbach W., Laskay T. Highly purified lipoteichoic acid activates neutrophil granulocytes and
delays their spontaneous apoptosis via CD14 and TLR2 // J. Leukoc. Biol. – 2004. – Vol.75(3). – P.
467-477.
7. Арчибальд А.Р. Методы исследования углеводов. – М:
”Выс. школа”, 1975. – 350 с.
8. Muller F., Rollang H. Nitroblue
tetrazolium reduction in monocytes monocyte-derived macrophages. Effect of
oxidative burst stimulants and interferons // APMIS. –
97. – 1989. – P.490-496.