Биологические науки/Биохимия
и биофизика
Доц. Целевич М.В., студент
Тимчак М.,
Доц. Галан М.Б., Проф. Санагурський Д.І.
Львівський національний
університет імені Івана Франка, Львів
Дисперсійний
аналіз впливу катіонів двовалентних металів на базальну Mg2+-залежну
АТФ-азу зародків в’юна
Молекулярні
механізми токсичної дії деяких біологічно важливих металів часто пов’язують не
лише з унікальними функціями цих металів, а що не менш важливо, з їх
антагоністичними властивостями в реалізації транспортних процесів клітин.
Токсичний вплив кадмію пов'язаний з його кумуляцією в організмі, а також зі
здатністю ініціювати вільно радикальне окислення [9], що є причиною пошкодження
мембранних та інших ліпопротеїдів, інактивації мембранних ферментів,
пригнічення поділу клітин. У дослідженнях впливу на організм коропа лускатого (Cyprinus carpo L.) [6] іонів цинку,
марганцю та свинцю, а також за умов їх сумісного впливу, спостерігали зміни
активностей супероксиддисмкутази, каталази, глутатіонпероксидази та посилення
процесів пероксидації ліпідів, що свідчить про розбалансування системи антиоксидантного
захисту. Як відомо, цинк, незважаючи на постійну валентність, істотно впливає
на редокс-статус клітини, що надзвичайно важливо для зародкових клітин, через
зміну співвідношення вмісту тіолів як у вільному стані, так і у координованих
зв’язках з металом (враховуючи й Ме2+-звязуючі центри мембранних
ферментів) [8].
Зародки попередньо
гомогенізували, а рештки зародкового жовтка осаджували центрифугуванням
упродовж 10 хв при 1600 g, як описано у статті [3]. Питому
активність Ca2+-незалежної, Mg2+-залежної АТФ-ази
визначали за відсутності екзогенних іонів Ca2+, з додаванням 1 мМ
EГTA та відповідних інгібіторів: 1 мМ уабаїну (інгібітор Na+, K+-АТФ-ази ПМ) та NaN3 (інгібітор АТФ-ази мітохондрій), 0,1 мкМ тапсигаргіну
(інгібітор Ca2+, Mg2+-АТФ-ази ЕПР) [5]. Як контроль на кількість ендогенного
неорганічного фосфору (Рі) у мембранах зародків
використовували суспензію мембранного препарату у середовищі Гольтфретера.
Мета роботи – кількісно оцінити вплив чинника часу (тривалості розвитку
зародків в’юна від стадії 2 бластомерів до стадії 10 поділу) і катіонів металів
(10-4ч10-6 М) на зміни Mg2+-залежної
АТФ-гідролазної активності мембран зародків Misgurnus fossilis L.
Вихідним матеріалом були попередньо отримані дані інгібування катіонами Cd2+,
Zn2+, Mn2+ Mg2+-АТФ-ази зародків на стадіях
розвитку: 2 (60 хв), 16 (150 хв), 64 (210 хв) бластомерів, 8 (270 хв) та 10 (330
хв) поділів. Дисперсійний аналіз виконували за допомогою програмного пакета Microsoft
Excel, яким оцінювали також вірогідність результатів [4].
|
|
|
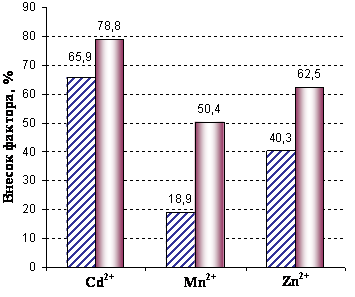
Рис. 1. Вплив катіонів металів на активність Mg2+-АТФ
ази зародків в’юна; р<0,001
(вплив фактора наявності досліджуваних чинників у середовищі). |
Якщо порівнювати внесок фактора часу і фактора наявності катіонів Cd2+,
Zn2+, Mn2+ в інкубаційному середовищі на зміни Mg2+-АТФ-азної
активності зародків протягом різних стадій розвитку без і з врахуванням
контролю, то цей внесок в обох випадках є не близьким за величиною. У випадку
врахування контролю для катіонів Cd2+ він становить 78,8%, а без
врахування контролю – 65,9% і в обох випадках є достовірним (р<0,001). Для
катіонів Zn2+ й Mn2+ виявлено значні, однак достовірні,
відмінності у значеннях внеску фактора наявності відповідної концентрації
катіонів досліджуваних металів (див. рис. 1).
Внесок фактора тривалості розвитку (або часу) за наявності в
інкубаційному середовищі катіонів двовалентних металів на зміни Mg2+-АТФ-ази
у всіх випадках є неоднаковим. Як видно з рис. 2, частка впливу чинника тривалості
розвитку зародків, без врахування контролю, є в середньому на 20ч30% більша,
ніж з врахуванням контролю.
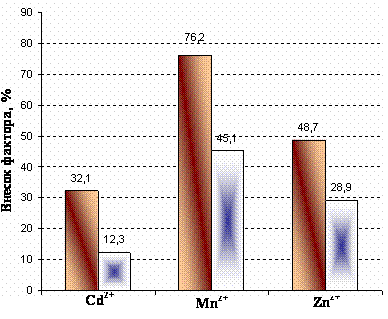
|
|
|||
|
Рис. 2. Вплив
катіонів металів на активність Mg2+-АТФ ази зародків в’юна; р<0,001 (вплив фактора тривалості розвитку). |
Так, навіть для катіонів Cd2+, для яких характерний найбільший
інгібувальний вплив упродовж всіх досліджуваних стадій розвитку, значення
фактора часу з врахуванням контролю становить 12,3%, а без – 32,1%
(р<0,001), однак в першому випадку він є недостовірним. Для Zn2+
й Mn2+ різниця між значеннями частки фактора тривалості розвитку у
зміни досліджуваного ферментативного гідролізу АТФ зародками є більш вираженою.
На підставі отриманих результатів двофакторного дисперсійного аналізу
можна стверджувати, що зміни Мg2+-АТФ-азної активності зумовлені
дією не тільки досліджуваного інгібітора (в даному випадку катіонів
двовалентних металів), але водночас залежать і від тривалості розвитку зародків
(стадії розвитку). На відміну від отриманих результатів дисперсійного аналізу
для Na+, K+-АТФ-ази [2], не виявлено залежності змін АТФ-ази
від чинника тривалості розвитку. Це в свою чергу свідчить, що Мg2+-АТФ-аза
є більш чутливою до динамічних процесів перебудов мембран зародків упродовж ембріогенезу
[7]. Дані, що були одержані,
можуть мати значення для подальшого розуміння ролі реакції Mg2+-залежного ферментативного гідролізу
АТФ у забезпеченні внутрішньоклітинного іонного гомеостазу зародків протягом
онтогенезу та механізмів впливу катіонів двовалентних металів.
Література
1. Гойда О.А. Биофизические
аспекты раннего онтогенеза животных. – К.: Наук. думка, 1993. – 224 с.
2. Івашків Л.Я., Целевич М.В.,
Бойко Н.М., Санагурський Д.І.
Дисперсійний аналіз впливу катіонів Cd2+, Zn2+, Mn2+ на активність Nа+, K+-АТФази
мембран зародків в’юна // Укр. Біохім. журн. – 2005. – Т. 77, №3. – С. 44-48.
3. Луцик М.Д., Кусень С.И.,
Лук’яненко А.В. Очистка и частичная характеристика плазматических
мембран клеток зародышей вьюна // Онтогенез. – 1986. – Т. 17, №3. – С. 314-321.
4. Любищев А.А. Дисперсионный
анализ в биологии. – М.: Изд-во Моск. Ун-та, 1986. – 200 с.
6. Мудра А.Є. Вміст заліза і
магнію у печінці коропа за забруднення середовища солями важких металів //
Медична хімія. – 2004. – Т. 6, № 3. – С. 44-47.
7.
Ротт Н.Н. Клеточные циклы в раннем эмбриональном развитии. –
М.: Наука, 1987. – 207с.
8. Maret W.,
Vallee B.L.
Thiolate ligands in metallothionein confer redox activity on zinc clusters // PNAS USA.
– 1998. – V. 95 (7). – P. 3478-3482.
9. Stacey N.H.,
Cantilena
L.R.Jr., Klaassen C.D.
Cadmium toxicity and lipid peroxidation in isolated rat hepatocytes
// Toxicology
and applied pharmacology. – 1980. – V. 53 (3).
– P. 470-480.