Панасюк А.Г.
Украинский государственный химико-технологический университет, г.Днепропетровск.
Синтез и некоторые химические свойства тетразолсодержащих тиосемикарбазидов
Достижения в химии тетразола и его производных в последнее десятилетие в значительной степени связаны с широким применением этих соединений в качестве химфармпрепаратов [1-4], в органическом синтезе[1,4,5], в качестве энергоемких материалов- взрывчатых веществ, компонентов твердых ракетных топлив[1,6-9], газогенерирующих составов[10], радиохромных красителей в дозиметрии[11] и др. Это стало возможным благодаря разработке новых и усовершенствованию известных методов функционализации тетразолов[1,4,5]. Одним из простых и перспективных способов получения 1,5-дизамещенных тетразолов является замещение алкилсульфонильной или алкилсульфинильной групп, связанных с атомом углерода гетероцикла, под действием С-,N-,О- нуклеофилов[1,12,13]. Исходные производные 5-меркаптотетразола значительно более доступны, чем соответствующие 5-хлорзамещенные тетразолы[1].
С другой стороны, несмотря на обилие публикаций по химии тетразола[1,4,5], тиосемикарбазиды, содержащие тетразольный фрагмент, являются малоизученными соединениями.
В связи с вышеизложенным, нами синтезированы в 5 стадий 4–арил(алкил)–1–(1′–фенил–5′–тетразолил)тиосемикарбазиды:
а) взаимодействием фенилизотиоцианата с азидом в водном растворе с последующим подкислением [14] получен 1–фенил–5–меркаптотетразол:
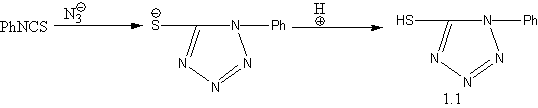
б) алкилированием полученного меркаптопроизводного синтезированы 1–фенил–5–алкилмеркаптотетразолы [15,16]:
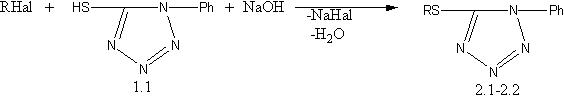
R=CH3, C2H5; Hal=Br, I;
в) окислениием соединений 2.1–2.2 действием КМnO4 [15,16] получены 1–фенил–5–алкилсульфонилтетразолы:
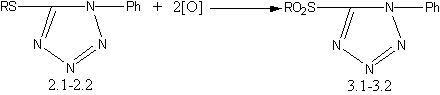
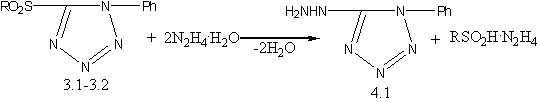
г) действием избытка гидразин - гидрата на сульфоны 3.1-3.2 синтезирован 1–фенил–5–гидразинотетразол[17]:
д) взаимодействием гетарилгидразина 4.1 с алкил(арил)изотиоцианатами получены конечные тиосемикарбазиды 5.1–5.5:
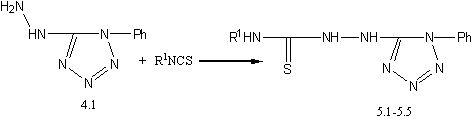
где R1=Ph, 4–BrC6H4, 4–ClC6H4,C2H5, 1–нафтил
Химические свойства
Алкилированием соединения 5.1 действием СН3І в абсолютном метаноле получена соль соответствующего S–метилизотиосемикрбазида:
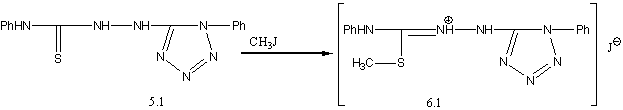 Действием
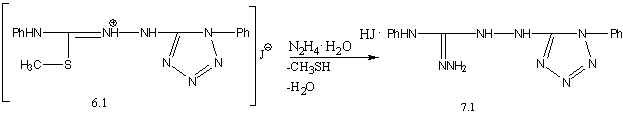
гидразингидрата на соединение 6.1 в спиртовом растворе получен соответствующий N–фениламино–N′–(1′–фенил–5′–тетразолиламино)
гуанидин (в виде гидройодида):
Действием
гидразингидрата на соединение 6.1 в спиртовом растворе получен соответствующий N–фениламино–N′–(1′–фенил–5′–тетразолиламино)
гуанидин (в виде гидройодида):
 Состав и строение
полученных соединений и интермедиатов доказывали методами элементного анализа,
ПМР– и ИК–спектроскопии. ПМР-спектры соединений 5.1-5.5 подобны. В частности, в
спектре соединения 5.4 имеются сигналы протонов СН3-группы в области
1.07м. д. (т), а также СН2-группы в области 3.46 м. д. (т).
Ароматические протоны дают сигналы в области 7.0-8.0 м. д. В частности, сигналы
фенильных протонов 1- фенилтетразолильного заместителя –мультиплет в области
7.53-7.72 м.д.
Состав и строение
полученных соединений и интермедиатов доказывали методами элементного анализа,
ПМР– и ИК–спектроскопии. ПМР-спектры соединений 5.1-5.5 подобны. В частности, в
спектре соединения 5.4 имеются сигналы протонов СН3-группы в области
1.07м. д. (т), а также СН2-группы в области 3.46 м. д. (т).
Ароматические протоны дают сигналы в области 7.0-8.0 м. д. В частности, сигналы
фенильных протонов 1- фенилтетразолильного заместителя –мультиплет в области
7.53-7.72 м.д.
Табл.1 Физико–химические свойства тиосемикарбазидов 5.1–5.5
|
Шифр соеди- нения |
R1 |
Тпл, оС |
Брутто-формула |
Найдено Вычислено, % |
|
|
N |
S |
||||
|
5.1 |
C6H5 |
146-147 |
С14Н13N7S |
31,59 31,49 |
10,12 10,30 |
|
5.2 |
4–BrC6H4 |
167-168 |
С14Н12BrN7S |
25,40 25,12 |
8,35 8,22 |
|
5.3 |
4–ClC6H4 |
169-171 |
С14Н12ClN7S |
28,61 28,35 |
9,11 9,27 |
|
5.4 |
C2H5 |
98-100 |
С10Н13N7S |
37,08 37,24 |
12,44 12,18 |
|
5.5 |
1–нафтил |
|
С18Н15N7S |
27,60 27,13 |
8,51 8,87 |
Комплексообразующие
свойства
При взаимодействии
тиосемикарбaзидов 5.1–5.5 с Cu(OAc)2∙Н2О
при кипячении в спиртовой среде легко с практически количественным выходом
образуются соответствующие хелаты меди(ІІ):
 Вместо ацетата можно использовать
другие соли Cu(II) слабых кислот, например, монохлорацетат, но процесс лучше
вести в водно-спиртовой среде. В абсолютной спиртовой среде при подкислении
возможна смешаннолигандная
координация с участием аниона, в часности, ClCH2COO–.
Вместо ацетата можно использовать
другие соли Cu(II) слабых кислот, например, монохлорацетат, но процесс лучше
вести в водно-спиртовой среде. В абсолютной спиртовой среде при подкислении
возможна смешаннолигандная
координация с участием аниона, в часности, ClCH2COO–.
Ренее [18] нами был получен смешаннолигандный комплекс меди(III) на основе n–анизидида
бензимидазол–2–тиокарбоновой кислоты и ClO4–аниона. В аналогичных условиях при взаимодействии
хелатов 8.1–8.3 в присутствие значительного молярного избытка 69% HClO4 в горячем
безводном 2–пропаноле в течение нескольких часов были получены комплексы
черного цвета по схеме:
4CuL21-5 + 4HClO4+O2 = 4CuL21-5ClO4+2H2O
8.1-8.3 9.1-9.3
Состав соединений был подтвержден предварительными данными элементного анализа, а строение–методами ИК– и ЭПР–спектроскопии. В частности, в ИК–спектрах комплексов 9.1–9.3 имеется сильно интенсивная полоса колебаний υ (СlO4–) в области 1130-1080 см–1. Данные ЭПР - спектров подтверждают диамагнитность соединений 9.1–9.3, т.е., по нашему мнению, получены комплексные соединения Cu(III), в которых центральный атом имеет к.ч., равное 5.
Таким образом, с использованием сравнительно доступных 1–арил–5–меркаптотетразолов нами предложен способ синтеза замещенных тетразолсодержащих тиосемикарбазидов. Полученные соединения являются удобными реагентами при получении замещенных тетразолсодержащих (поли)аминогуанидинов, а последние – перспективными синтонами получения соответствующих линейных полиазотистых систем, содержащих 2 азольных (замещенных тетразольных, триазольных) фрагмента. Кроме того, данные тиосемикарбазиды легко образуют хелатные комплексы меди(ІІ), содержащие координационный узел CuN2S2. Впервые показана возможность стабилизации дизамещенными тиосемикарбазидами, содержащими тетразольный фрагмент, степени окисления меди (+3) в составе смешаннолигандных комплексов, содержащих ClO4––анион.
Гетероциклические
тиосемикарбазиды и их функциональные производные являются потенциальными
биологически активными соединениями. Кроме того, комплексы Cu(ІІІ) могут быть объектами при изучении каталитической активности их
в качестве возможных катализаторов горения твердых ракетных топлив (ТРТ), а
также возможно их применение как компонентов смесевых инициирующих взрывчатых
веществ (ИВВ) (по аналогии с описанным в работах [19,9]).
Литература
1.Колдобский Г.И., Островский В.А./ Успехи химии. 1994.Т.63.
№10.С.847-864.
2.Schmidt
В., Schieffer B./ J. Med. Chem.2003.№46.P.2261.
3.Bekhit
A.A., El-Sayed O.A. Aboulmagd E., Park J. Y./ J. Med. Chem. 2004. №39.Р.249.
4.Колдобский Г.И./
ЖОрХ.2006.Т.42.№4.С.487-504.
5.Колдобский Г.И., Островский В.А., Поплавский В.С./ХГС. 1981.№10.С.1299-1326.
6.Илюшин М. А.,
Терпигорев И. В., Целинский И.В./ЖОХ.1999.Т.69.№10.С.1727-1730.
7.Klapotke
T.M., Mayer P., Schulz A., Weigand J.J./ JACS.2005.V.127.P.2032-2036.
8.Boyer
J. Organic nitrochemistry. Ser.1. Chapter 4. Nitrotriazoles and
Nitrotetrazoles.P.268-300.
9.Жилин А.Ю.,
Илюшин М.А., Целинский И.В. Козлов А.С. и др./ЖПХ.2005.Т.78.№2.С.195-199.
10.Miyata
Y., Date S., Hasue K./ Propellants, Explosives, Pyrotechnics. 2004. V.29.P.247.
11.Moussa
A., Baranyai M., Wojnarovits L., Kovacs A., McLaughlin W.L./ Radiat. Phys.
Chem.2003. V.68.P.1011-1016.
12.Артамонова
Т.В., Зацепина М.В., Колдобский Г.И. / ЖОрХ.2004.Т.40.С.1366.
13.Hrabalеk
A., Myznikov L, Кunes J., Vavrova K., Koldobskii G./ Tetrahedron Lett. 2004.
V.45.P.7955-7956.
14.Дубенко
Р.Г. и др. /ХГС. Сб.1.1967.С.199-201.
15.Ниренбург
В.Л., Постовский И.Я., Черткова Э.И./ Изв. ВУЗов. Химия и хим технология.
1965.№2.С.258-261.
16.Гольцберг
М.А., Грабалек А., Фарса О., Кребс А., Долежал П., Колдобский
Г.И/ ЖОрХ.1996. Т.32. №9.С.1415-1417.
17.Новикова
А.П., Беднягина Н.П., Постовский И.Я./ХГС. Сб.1.1967.С.195-198.
18.Panasyuk
A.G., Ranskii A.P., Aliev Z.G. /Russian J. of Coord. Chem. 2005. V. 31. №1. P.
40-44.
19.Бачурина
И.В., Илюшин М.А, Груздев Ю.А. и др./ Мат. VIII
Междунар. молод. конф. «Человек и космос». 2006.С.372.