Химия и химические технологии/6. Органическая химия
Ст. викл.
Леденёва О.П.
Учебно-научный
профессионально-педагогический институт
Украинской
инженерно-педагогической академии, Украина
Гидрохлорирование незамещенных в хиноидном ядре
4-Амино-N-ацетилфенол (парацетамол)
является эффективным обезболивающим средством, а продукт его окисления N-ацетил-1,4-бензохинонимин
является промежуточным соединением в цепочке превращений, обусловливающих
гепатотоксичность парацетамола [1].
4-Амино-N-ароилфенолы
являются аналогами парацетамола, на их
основе также ведется поиск лекарственных препаратов [2]. В результате окисления
данных соединений образуются N-ароил-1,4-бензохинонимины.
Ранее было высказано предположение, что гидрохлорирование незамещенных в
хиноидном ядре N-ацил-1,4-бензохинониминов может протекать как по
схеме 1,4-присоединения, так и 6,3-присоединения [3]. В связи с этим целью
настоящей работы является определение направления присоединения атома хлора при
гидрохлорировании N-ацил-1,4-бензохинониминов.
Гидрохлорирование проводили пропусканием газообразного хлороводорода через
раствор хинониминов (IIа–е) в хлороформе (схема 1).
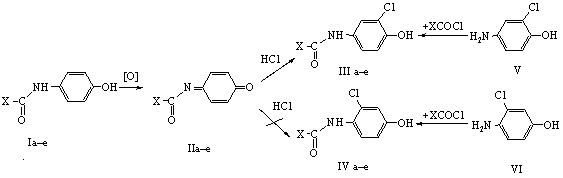
(1)
X = Me (a),4-MeOC6H4
(б), 4-СН3С6Н4 (в), С6Н5 (г), 4-СlС6Н4 (д), 4-NO2С6Н4 (e).
Продукты гидрохлорирования анализировали с помощью ЯМР-спектроскопии без
какой-либо дополнительной очистки. Для точной идентификации продуктов встречным
синтезом в результате реакции 4-амино-2-хлорфенола (V) и 4-амино-3-хлорфенола (VI) с
ацетил(ароил)-хлоридами были получены 4-амино-N-ацетил(ароил)-2-хлорфенолы (IIIа–е) и
4-амино-N-ацетил(ароил)-3-хлорфенолы (IVа–е).
Анализ спектров ЯМР 1Н продуктов гидрохлорирования показал, что
образуются только 4-амино-N-ацетил(ароил)-2-хлорфенолы (IIIа–е),
продукты 6,3-присоединения – аминофенолы (IVа–е) обнаружены не были, но
реакционные смеси содержали примеси восстановленных форм исходных
хинонмоноиминов – аминофенолы (Iа–е) и продукты гидролиза.
С целью исследования механизма гидрохлорирования N-ацил-1,4-бензохинониминов (IIа–е) были
выполнены квантово-химические расчеты. Для хинониминов (IIа, г)
методом DFT (B3LYP) с использованием базисного набора 6-31+G(d) были выполнены оптимизации
по всем геометрическим параметрам исходных хинонмоноиминов и возможных
переходных состояний, которые могут образовываться при гидрохлорировании.
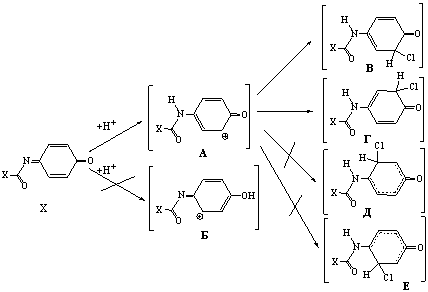 На первом этапе гидрохлорирования происходит
протонирование N-ацил-1,4-бензохинониминов (IIа–е) по атому азота, т.к.
является более выгодным, чем по атому кислорода (схема 2).
На первом этапе гидрохлорирования происходит
протонирование N-ацил-1,4-бензохинониминов (IIа–е) по атому азота, т.к.
является более выгодным, чем по атому кислорода (схема 2).
(2)
Энергия протонированной формы (А)
хинонимина (IIа) составляет -514,58628, (IIг) –
-706,34282 ат.ед., протонированной формы (Б)
хинонимина (IIа) – -514,57866, (IIг) – -706,32120 ат.ед. То есть
энергия переходного состояния (А)
хинонимина (IIа) меньше энергии протонированной формы по атому
кислорода (Б) на 20 кДж/моль, а
хинонимина (IIг) – на 56,8 кДж/моль.
На втором этапе к промежуточному катиону (А) присоединяется анион хлора. Согласно расчетам энергии возможных
переходных структур (В, Г, Д,
Е) составили: (В) – -975,06881, (Г) –
-975,06827, (Д) – -975,01035, (Е) – -974,98688 ат.ед. (Х=Ме) и (В) – -1166,81199, (Г) – -1166,81139, (Д) –
-1166,75576, (Е) – -1166,73110
ат.ед. (Х=Ph). То есть более выгодными являются структуры (В, Г),
энергия которых является практически одинаковой, в то время как энергия
структуры (Д) больше энергии
структуры (Г) на 152,1 кДж/моль
(Х=Ме), 140,6 кДж/моль (Х=Ph), а энергия структуры (Е) превышает энергию структуры (В) на 215,1 кДж/моль (Х=Ме), 212,4
кДж/моль (Х=Ph).
Таким образом, при гидрохлорировании N-ацил-1,4-бензохинониминов
вначале происходит протонирование более основного атома азота, а затем присоединение
аниона хлора в орто-положение к
карбонильному атому углерода. Присоединение аниона хлора в орто-положение к иминному атому углерода является энергетически
невыгодным, поэтому при гидрохлорировании N-ацил-1,4-бензохинониминов
образуются только продукты 1,4-присоединения.
Литература:
1.
Mechanisms of N-acetyl-p-benzoquinone imine cytotoxicity /
E. Albano, M. Rundgren, P. J. Harvison [et al.] // Molecular Pharmacology. –1985. – Vol. 28.
– P. 306–311.
2.
Toward
optimization of the linker substructure common to transthyretin amyloidogenesis
inhibitors using biochemical and structural studies / S. M. Johnson, S.
Connelly, I. A. Wilson [et al.] // Journal
of Medicinal Chemistry. – 2008. – Vol. 51, № 20. – P. 6348–6358.
3.
Авдеенко
А.П. Гидрохлорирование и гидробромирование N-(N-арилсульфониларилимидоил)-1,4-бензохинониминов
/ А. П. Авдеенко, И. Л. Марченко, С. А. Коновалова // Журнал
органической химии.– 2001.
– Т. 37. – Вып. 1. – Вып.1. – С. 82–92.