Евразийский национальный университет им.
Л.Н. Гумилева, Казахстан
Влияние активности импортина на работу киназы mTOR
Мишень рапамицина у млекопитающих – mTOR (mammalian target of
rapamycin), является PI3K связанной Ser/Thr киназой, которая регулирует рост, пролиферацию и выживание клеток за счет интеграции различных внешних
сигналов во внутриклеточные механизмы
через два известных mTOR содержащих комплекса,
mTOR комплекс 1 (mTORC1)
и mTORC2 [1, 2]. Нарушения в сигнальной системе mTOR часто связано с рака
человека [3] и участвует в широком спектре
патогенных условий и процессов,
в том числе заболеваний обмена веществ,
эпилептогенеза и старения
[1, 4, 5]. Из-за своей основной роли в трансляции, mTOR рассматривается в качестве исключительно цитоплазматического белка. Однако эта точка зрения меняется в результате последних полученных данных, показывая,
что mTOR локализуется в многочисленных
клеточных компонентах, в том числе Аппарате
Гольджи [6, 7], эндоплазматической сети [7, 8], митохондриальной наружной мембране [9],
лизосомах [10] и ядре [11-14].
Было показано, что функции каждой клеточной области зависит от специфичности
субстрата [15]. Также было показано, что
mTOR
аккумулируется в определенном месте аппарата Гольджи вместе с компонентами аутофагии в Ras-индуцированном старении,
которое ассоциируется с синтезом интерлейкина-6/8
[6].
Восходящие сигналы и
механизмы, приводящие к пространственному
расположению mTOR, функции mTOR в этих клеточных отсеках и образование mTOR комплексов,
отличных от mTORC1 и mTORC2 все еще до конца не изучены. Очевидно, что выявление
новых отсеков
специфически зависящих от субстратов mTOR расширит наше
представление о функциональном разнообразии
mTOR сигнализации.
Ядерная деятельность mTOR была связана с
увеличением ее цитоплазматических
функций в контроле трансляции белка [16]. Транспорт mTOR между цитозолем
и ядром, как было показано, увеличивает его киназный потенциал в цитоплазме [13, 17]. Было показано,
что связывание mTOR с
промоутерами генов rDNA и tRNA повышает потенциал
биосинтеза белка [16]. Тем не
менее, имеющиеся данные указывают на дополнительную роль
mTOR в ядре.
Цель данной работы изучить взаимодействие активности
белка Importin
β1 с киназой mTOR методом нокдауна генов.
Материалы и методы.
Для
нокдауна генов использовали 3, 75 мг разведенной упаковочной смеси (0,75 мг pCMV-VSVG :
3мг pCMV-delta VPR
8,91) и 2,25 мг ДНК вируса pLenti. К
этой смеси добавляли микроРНК изучаемого белка в соотношении – shRNA:ΔVPR:VSVG =
3:4:1. Инкубировали полученную смесь 20 минут при комнатной температуре с
липофектамином-2000 для формирования комплексов. Для накопления массы вируса
использовали линию клеток 293Т в количестве 3×106 на 6 см
чашках, которые инкубировали при 37°С в течении трех суток. Для проведения
нокдауна генов использовали линию клеток MDA-MB-435
в концентрации 2×105. Заражение проводили путем внесения
вируссодержащей суспензии с полибреном концентрацией 8 мг/мл. Селекцию
нокаутированных клеток проводили в течение 48 часов с помощью пиромицина,
концентрация которого в культуральной ростовой средой составляла 3 мг/мл.
Для
разделения белковых образцов нами использовались коммерческие градиентные гели
4-12% (фирма «BioRad»,
США). Перенос белков из электрофорезного геля на нитроцеллюлозную мембрану
осуществляли с помощью прибора для иммуноблотинга Owl VEP-2
по H. Towbin et al. Проявление изучаемых белков на мембране проводили с
использованием специфических антител (фирма «Santa Cruz»,
США). Для лизирования клеток использовали буфер, состоящий из 10 мМ Трис-HCl, pH7.5,
2.5 мМ MgCl2,
1.5 мМ KCl,
0.5% Тритон X-100,
0,2 М LiCl,
0.5% деоксихолата натрия (C24H39NaO4).
Результаты исследований.
При
проведении нокдауна генов нами использовалось два вида микроРНК изучаемого
белка Importin
β1 для подтверждения эффекта реакции. В качестве контроля использовали микроРНК
Luciferase.
После заражения клеточной культуры и пиромициновой селекции проводили изучение
морфологических и биохимических показателей клеток, рисунок 1 и 2.
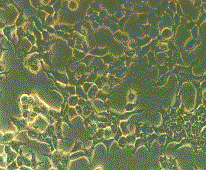
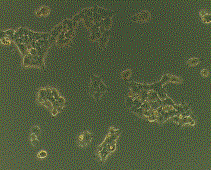
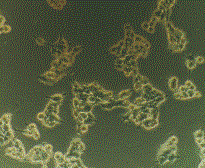
Контроль shRNA Importin #1 shRNA Importin #2
Рисунок 1 – Морфология клеток в норме и при нокдауне
генов
Данные рисунка 1 показывают морфологические изменения
клеток, в которых был проведен нокдаун гена, отвечающего за синтез белка Importin β1. Клетки приобретали округлую форму, маленький
размер, низкую скорость роста и плохую способность фиксации к поверхности
матраса. Все эти глобальные морфологические и физиологические изменения говорят
о важности данного белка в жизнедеятельности клетки и необходимости более
тщательного изучения комплексов и процессов, связанных с этим белком.
Дальнейшие исследования включали проведение лизиса
нокаутированных клеток, иммунопреципитацию изучаемых белков, проведение
электрофоретического анализа и иммуноблотинга. Для иммунопреципитации
использовали специфические антитела против белков RanBP2, mTOR и Importin β1, позволяющие изолировать специфические
комплексы. Электрофоретическому анализу
нами были подвергнуты образцы полученные методом иммунопреципитации и общие
клеточные лизаты с одинаковым количеством белка, рисунок 2.
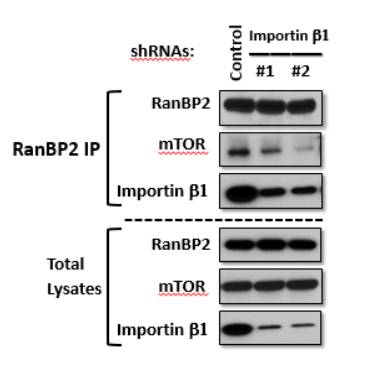
Рисунок 2 – Биохимические показатели комплексообразования
при нокдауне генов белка Importin β1
На рисунке 2 показаны результаты,
позволяющие изучить активность белков при нокдауне гена, ответственного за
синтез белка Importin β1. Количественное содержание белка Importin β1 в образцах общих клеточных лизатов, где
произведен нокдаун, намного меньше, чем в контрольном образце. Это говорит о
сниженной экспрессии изучаемого гена в культуре клеток. При этом количественное
содержание белков RanBP2 и mTOR общих лизатов не изменилось и остается на одинаковом
уровне с контрольным образцом.
Если же рассматривать данные,
полученные методом иммунопреципитации, то на рисунке два видно, что в образцах,
где был произведен нокдаун гена белка Importin β1, происходит снижение не только самого
нокаутированного белка, но и киназы mTOR. Это говорит об активной взаимосвязи белков Importin β1 и mTOR именно в активной их форме, т.е. при образовании
комплексов на стадии транспорта веществ из цитоплазмы в ядро клетки.
Таким образом, проведенные нами исследования показывают
важность белка Importin
β1 в жизнедеятельности клетки, его влияние на морфологические и
физиологические свойства клетки. Кроме этого показана взаимосвязь активных форм
транспортного белка Importin β1 и киназы mTOR, их комплексное взаимодействие.
Литература:
1. Zoncu R., Efeyan A., Sabatini D.M. mTOR:
from growth signal integration to cancer, diabetes and ageing. // Nat. Rev.
Mol. Cell Biol. – 2011. – Vol. 12. – P. 21-35.
2. Guertin D.A., Sabatini D.M. Defining the
role of mTOR in cancer. // Cancer Cell. – 2007. – Vol. 12. – P. 9-22.
3. Wander S.A., Hennessy B.T., Slingerland J.M.
Next-generation mTOR inhibitors in clinical oncology: how pathway complexity
informs therapeutic strategy. // J. Clin. Invest. – 2011. – Vol. 121. – P.
1231-41.
4. Pani G. P66SHC and ageing: ROS and TOR? //
Aging (Albany NY). – 2010. – Vol. 2. – P. 514-8.
5. Zeng L.H., McDaniel S., Rensing N.R., Wong
M. Regulation of cell death and epileptogenesis by the mammalian target of
rapamycin (mTOR): a double-edged sword? // Cell Cycle. – 2010. – Vol. 9. – P.
2281-5.
6. Narita M., Young A.R., Arakawa S.,
Samarajiwa S.A., Nakashima T., Yoshida S. et al. Spatial coupling of mTOR and
autophagy augments secretory phenotypes. // Science. – 2011. – Vol. 332. – P.
966-70.
7. Drenan R.M., Liu X., Bertram P.G., Zheng
X.F. FKBP12-rapamycin-associated protein or mammalian target of rapamycin
(FRAP/mTOR) localization in the endoplasmic reticulum and the Golgi apparatus.
// J. Biol. Chem. – 2004. – Vol. 279. – P. 772-8.
8. Liu X., Zheng X.F. Endoplasmic reticulum and
Golgi localization sequences for mammalian target of rapamycin. // Mol. Biol.
Cell. – 2007. – Vol. 18. – P. 1073-82.
9. Desai B.N., Myers B.R., Schreiber S.L.
FKBP12-rapamycin-associated protein associates with mitochondria and senses
osmotic stress via mitochondrial dysfunction. // Proc. Natl. Acad. Sci. USA. –
2002. – Vol. 99. – P. 4319-24.
10. Sancak
Y., Bar-Peled L., Zoncu R., Markhard A.L., Nada S., Sabatini D.M. Ragulator-Rag
Complex Targets mTORC1 to the Lysosomal Surface and Is Necessary for Its
Activation by Amino Acids. // Cell. – 2010. – Vol. 141. – P.290-303.
11. Wang X., Proud C.G. mTORC1 signaling: what
we still don’t know. // J. Mol. Cell Biol. – 2011. – Vol. 3. – P. 206-20.
12. Zhang X.,
Shu L., Hosoi H., Murti K.G., Houghton P.J. Predominant nuclear localization of
mammalian target of rapamycin in normal and malignant cells in culture. // J.
Biol. Chem. – 2002. – Vol. 277. – P. 28127-34.
13. Bachmann
R.A., Kim J.H., Wu A.L., Park I.H., Chen J. A nuclear transport signal in
mammalian target of rapamycin is critical for its cytoplasmic signaling to S6
kinase 1. // J. Bio.l Chem. – 2006. – Vol. 281. – P. 7357-63.
14. Wei Y,
Zheng X. TORC1 association with rDNA chromatin as a mechanism to co-regulate
Pol I and Pol III. // Cell Cycle. – 2009. – Vol.8. – P.3802-3.
15. Cunningham JT, Rodgers JT, Arlow DH, Vazquez
F, Mootha VK, Puigserver P. mTOR controls mitochondrial oxidative function
through a YY1-PGC-1[agr] transcriptional complex. // Nature. – 2007. – Vol.
450. – P. 736-40.
16. Jiang Y.
mTOR goes to the nucleus. // Cell Cycle. – 2010. – Vol. 9. – P. 868-872.
17. Park I.H., Bachmann R., Shirazi H., Chen J.
Regulation of ribosomal S6 kinase 2 by mammalian target of rapamycin. // J.
Biol. Chem. – 2002. – Vol. 277. – P. 31423-9.