Химия и химические технологии/6.
Органическая химия
Магистрант Суюндиков К.Д., д.х.н.,
профессор Сулейменов М.А.
Павлодарский государственный университет
им. С. Торайгырова
Непредельные
ацетиленовые углеводороды
Соединения
ряда ацетилена – один из интересных классов органических соединений. Вследствие
высокой реакционной способности они претерпевают разнообразные химические
превращения и дают начало огромному числу практически важных веществ
(синтетических покровных материалов, лекарственных веществ). Многие из них
являются многотоннажными продуктами тяжелого органического синтеза. Эта
обширная группа органических соединений характеризуется присутствием двух
атомов углерода, связанных тройной связью.
Номенклатура.
По рациональной номенклатуре названия углеводородов с тройной связью
производятся от простейшего алкина – ацетилена с указанием радикалов,
замещающих водород ацетилена. По правилам юпаковской номенклатуры названия
углеводородов, содержащих тройную связь, оканчиваются на –ин, поэтому они
называются алкинами. В таблице приведена номенклатура простейших непредельных
ацетиленовых углеводородов. Состав алкинов выражается общей формулой СnН2n-2.
Ацетилен
– линейная молекула, в которой все четыре атома расположены на одной прямой.
Связи углерод – водород и углерод – углерод обладают цилиндрической симметрией
относительно линии, соединяющей ядра, и, следовательно, являются -связями.
Получение
ацетилена и его гомологов. Ацетилен – наиболее ценный представитель соединений
ацетиленового ряда и исходный продукт при получении его гомологов.
Таблица
1 – Номенклатура ацетиленовых углеводородов (алкинов)
|
Структурная формула |
Номенклатура |
||
|
Историческая (тривиальная) |
Рациональная |
ЮПАК |
|
|
|
Ацетилен |
Ацетилен |
Этин |
|
|
Аллилен |
Метилацетилен |
Пропин |
|
|
Кротонилен |
Этилацетилен |
1-Бутин |
|
|
Кротонилен |
Диметилацетилен |
2-Бутин |
|
|
Валерилен |
Метилэтил-ацетилен |
2-Пентин |
|
|
Валерилен |
Пропилацетилен |
1-Пентин |
Ацетилен
получается двумя примерно равноценными по тоннажу методами: 1) из карбида
кальция; 2) из улеводородного сырья (окислительным пиролизом, электрокрекингом
и гомогенным пиролизом жидких углеводородов). Первый метод требует значительной
затраты электроэнергии, расходуемой на образование карбида кальция, второй
сопровождается образованием большого числа побочных продуктов.
Карбидный
метод: ![]()
![]()
Впервые ацетилен был получен Г. Дэви
из карбида кальция в 1831 г., карбид кальция был применен Ф. Велером в 1862 г.
Карбид магния используют для получения ацетилена, содержащего радиоактивный
изотоп углерода 14C.
Метод термокрекинга. Исходным сырьем
служат природный газ, различные углеводороды (этан, пропан, бутан) и нефтяные
погоны. Сущность метода заключается в быстром нагревании в течение 0,5 с
исходных продуктов до 1000 – 1300 оС и последующем быстром
охлаждении газовой смеси до 80 оС. При крекинге бутана выход
ацетилена составляет 25 – 30 %, после рециркуляции выход повышается до 50 – 55
%. Наряду с ацетиленом образуется диацетилен, являющийся интересным химическим
продуктом, а также этилен, этан, метан, водород и др.:
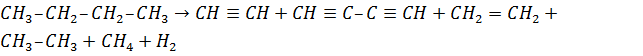
Кроме
того, перспективен метод окислительного пиролиза метана. Предварительно
нагретая смесь метана (99 % чистоты) и кислорода (98 % чистоты) кратковременно
(0,01 – 0,005 с) при 1400 – 1500 оС находится в зоне реактора и
затем охлаждается водой. Образовавшийся ацетилен абсорбцией и
низкотемпературной перегонкой отделяется от сопутствующих газов:
![]()
Общим способом получения алкинов
является дегидрогалогенирование дигалогенопроизводных спиртовым раствором
гидроксида калия.
Эта реакция открывает путь перехода
от этиленовых к ацетиленовым углеводородам.
Другой общий способ получения
гомологов ацетилена заключается в алкилировании металлических производных ацетилена–ацетиленидов:
![]()
Физические свойства. Закономерности
в температурах кипения и плотностях алкинов аналогичны закономерностям в
алканах и алкенах. Тройная связь повышает температуру кипения и плотность.
Физические свойства алкинов приведены в таблице 2.
Таблица 2 – Физические свойства
алкинов
|
Название |
Формула |
Температура, оС |
Плотность, |
|
|
Плавления |
Кипения |
|||
|
Ацетилен |
|
-81,8 |
-83,6 |
0,620 (при -80 оС) |
|
Пропин |
|
-104,7 |
-23,3 |
0,678 (при - 27
оС) |
|
1-Бутин |
|
-130,0 |
-8,6 |
0,668 (при 0 оC) |
|
2-Бутин |
|
-32,3 |
27,2 |
0,688 (при 25 оС) |
Природа
тройной связи. Межъядерное расстояние атомов углерода в ацетилене (0,1203 нм)
меньше, чем в этене (0,1332 нм) и этане (0,154 нм).
Энергия
тройной связи в молекуле ацетилена равна 810 кДж/моль, а энергия ординарной
связи в молекуле этана – 348 кДж/моль. Энергия трех ординарных связей равна
1044 кДж/моль, т.е. на 234 кДж больше энергии тройной связи. Следовательно,
энергия тройной связи не является суммарной энергией трех ординарных.
Литература:
1.
Артеменко А. И. Органическая химия – М.
: Химия, 2006. – 407 с.
2.
Вольхин В. В. Общая химия. Основной курс
– М.: Химия, 2008. – 163 с.