д.м.н. Кручинина М.В., д.м.н. Курилович,
к.м.н. Громов А.А., Баум В.А,
член.-корр. Воевода М.И., Немцова Е.Г.,
Логвиненко Е.В., Ковалькова Н.А.
ФГБУ «НИИ терапии» СО РАМН, Новосибирск, Россия
к.т.н. Генералов В.М., к.т.н. Зайцев
Б.Н.
ФБУН ГНЦ ВБ
«Вектор», п. Кольцово, НСО
к.х.н. Кручинин В.Н., к.т.н. Рыхлицкий
С.В.
Институт физики полупроводников им. А.В.
Ржанова СО РАН, Новосибирск
д.ф.-м.н. Князев Б.А., Герасимов В.В.,
д.м.н. Покровский А.Г.,
к.м.н. Пустыльняк В.О., к.м.н. Чересиз
С.В., Сакаева Г.Р., Корбут А.И.
Институт ядерной физики им. Г. И. Будкера СО РАН,
Новосибирск, Россия
Новосибирский государственный университет,
Новосибирск, Россия
к.ф.-м.н. Анцыгин В.Д.
Институт автоматики и электрометрии СО
РАН, Новосибирск, Россия
Возможности оптических
методов исследования эритроцитов, сыворотки крови в диагностике степени фиброза
печени
Введение. Проблема разработки новых неинвазивных способов
диагностики степени фиброза печени по-прежнему остается наиболее актуальной в
гепатологии [1]. Поскольку известные методы диагностики (исследование сывороточных маркеров фиброза - коллагена I, III, IV типов, гиалуроновой кислоты,
ламинина и его фрагментов, YKL-40, металлопротеиназ, тканевых ингибиторов
металлопротеиназ, цитокинов; панели биохимических показателей; методы
визуализации – эластометрия печени, допплеровское исследование сосудов печени, ультразвуковое
исследование в В-режиме, компьютерная томография и магнитно-резонансная
томография) обладают порой недостаточной чувствительностью, специфичностью,
особенно в определении ранних стадий процесса фиброзирования в печени, зачастую
являются трудоемкими, дорогостоящими, труднодоступными для амбулаторной
практики [2].
Предшествующие измерения показали
перспективность использования оптических методов исследования эритроцитов и
сыворотки крови для определения степени фиброза печени [3,4,5]. Оптические методы занимают особое
место в биомедицинских исследованиях, благодаря высокой чувствительности,
неразрушающему и невозмущающему характеру воздействия на исследуемый объект [6].
Сочетанное использование вышеуказанных методик, включая терагерцовую
спектроскопию, атомно-силовую микроскопию, позволило достичь определенных
успехов в разграничении стадий процесса.
Цель. Изучить возможности оптических методов исследования эритроцитов, сыворотки
крови у пациентов с диффузной патологией печени для диагностики, разграничения степеней фиброза печени.
Материалы и методы. Обследованы: 27 мужчин (30-62 лет) без признаков патологии внутренних органов и фиброза печени (F0, первая группа); 66 мужчин в возрасте от 32 до 67 лет с диффузной патологией печени, преимущественно алкогольного, вирусного и смешанного генеза (21 пациент с легким фиброзом (F1, вторая группа); 19 больных – со степенью фиброза (F2, третья группа); 18 пациентов – с выраженным фиброзом (F3, четвертая группа); 8 мужчин – с циррозом печени (F4, пятая группа). Степень выраженности фиброза печени устанавливалась на основании данных биопсии печени, которая была проведена 25 пациентам с диффузными заболеваниями печени. У 41 пациента степень фиброза печени определялась макроморфологическими методами визуализации (УЗИ, КГ, ЯМРТ, непрямой эластометрией). У большинства больных была выявлена умеренная степень гистологической, биохимической активности хронического гепатита. Обследуемым проведено изучение электрических и вязкоупругих параметров эритроцитов методом диэлектрофореза в частотном диапазоне 5.104-106Гц, взвесей эритроцитов методами терагерцовой спектроскопии, атомно-силовой микроскопии; тонких пленок, полученных из сыворотки крови центрифугированием, методами спектральной эллипсометрии и спектроскопии комбинационного рассеяния света (Raman).
Обследование выполнено с одобрения Этического Комитета ФГБУ «НИИ терапии» СО РАМН от 18 сентября 2012, протокол N 36.
Результаты
исследования.
При исследовании взвесей эритроцитов
методом атомно-силовой микроскопии отмечено снижение числа двояковогнутых
дискоцитов по мере нарастания степени фиброза печени с увеличением количества
предгемолитических, дегенеративно измененных форм клеток (с множественными выростами, в виде спущенного мяча) (рис.1).
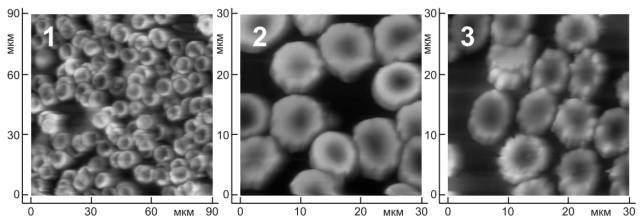
Рисунок 1. AFM фотографии эритроцитов у лиц
группы сравнения F0 (1), у пациентов с умеренным фиброзом F1-2 (2), и выраженным фиброзом F3-4 (3).
Изучение электрических
и вязкоупругих параметров эритроцитов методом диэлектрофореза выявило, что по
мере нарастания степени фиброза (от F0 в
группе сравнения до тяжелой F4 у пациентов с
циррозами) у обследуемых эритроциты становились более жесткими, с меньшей
способностью к деформации, склонными к образованию агрегатов, обладали низкой
резистентностью к воздействию стрессовых факторов различной интенсивности, а
поэтому легко разрушались как на низких, так и на высоких частотах при действии
электрического поля. Сниженная биологическая
активность клеток красной крови коррелировала с пониженными уровнями
поляризуемости клеток на всех частотах (r=0,66; p<0,01). Мембраны
эритроцитов становились утолщенными (что отражало достоверное снижение уровня
электрической емкости - p<0,001), с
высокой электропроводностью (в норме оболочки клеток красной крови являются
диэлектриками). Равновесная частота по мере нарастания фиброза оказалась
смещенной в высокочастотный диапазон (p<0,0001-0,05)
(таблица 1).
Таблица 1. Вязкоупругие и электрические характеристики
эритроцитов у больных с диффузной патологией печени с разной степенью фиброза
(M±m).
|
Показатели эритроцитов |
1
группа стадия
фиброза F0 n=27 |
2
группа стадия
фиброза F1 n=21 |
3 группа стадия
фиброза F2 n=19 |
4 группа стадия
фиброза F3 n=18 |
5 группа стадия
фиброза F4 n=8 |
|
Амплитуда деформации, [м] |
(2,88± 0,49)·10-6 |
(0,94+ 0,12)·10-6 ** |
(0,71+ 0,19)·10-6 *** |
(0,60+ 0,14)·10-6 ***^ |
(0,48+ 0,15)·10-6 ***^ |
|
Обобщенный показатель
жестко-сти, [Н/м] |
(3,96± 0,4)·10-6 |
(5,4+ 0,6).10-6 * |
(7,1+ 0,5).10-6 ***^ |
(10,1+ 0,6).10-6 ***^^^$$ |
(13,3+ 0,9).10-6 ***^^^$$$## |
|
Обобщ. показатель вязкости, [Па . с] |
0,31± 0,07 |
0,55+0,06 ** |
0,67+0,05 ***^ |
0,79+0,04 ***^^$ |
0,98+0,07 ***^^^$$## |
|
Индекс агрегации Er [усл.ед.] |
0,51 + 0,05 |
0,62± 0,04 * |
0,70 ± 0,03 ** |
0,75 ± 0,04 ***^ |
0,84 ± 0,05 ***^^$ |
|
Индекс деструкции Er [%] |
0,9+ 0,1 |
2,1+ 0,1 *** |
5,4+ 0,5 ***^^^ |
7,1+ 0,8 ***^^^$ |
9,5+ 1,1 ***^^^$$# |
|
Поляризуемость [м3]
(частота 106 Гц) |
(9,8± 0,2)·10-15 |
(7,9+ 0,4)·10-15 *** |
(6,4+ 0,6)·10-15 ***^ |
(5,9+ 0,7)·10-15 ***^ |
(4,1+ 0,5)·10-15 ***^^^$$# |
|
Электропровод-ность, [См/м] |
(2,4± 0,3)·10-5 |
(5,3+ 0,5)·10-5 *** |
(6,2+ 0,4)·10-5 *** |
(7,5+ 0,5)·10-5 ***^^$ |
(9,3+ 0,4)·10-5 ***^^^$$$# |
|
Емкость клеточной мембраны [Ф] |
(7,1± 0,4)·10-14 |
(6,2± 0,3)·10-14 * |
(5,5± 0,2)·10-14 ***^ |
(4,6± 0,3)·10-14 ***^^^$$ |
(2,8± 0,4)·10-14 ***^^^$$$### |
|
Скорость движения
электродам, [мкм/с] |
11,2+1,9 |
8,9+2,0 |
7,2+ 1,7 * |
5,9+ 2,1 * |
4,2+ 1,6 **^ |
|
Равновесная частота, [Гц] |
(4,9+ 0,4)·105 |
(5,7+ 0,5)·105 |
(6,9+ 0,4)·105 ***^ |
(7,7+ 0,4)·105 ***^^ |
(9,8+ 0,3)·105 ***^^^$$$### |
|
Дипольный
момент [Кл.м] |
(15,1± 2,1)·10-22 |
(9,7 ±1,9)·10-22 * |
(7,1± 1,7)·10-22 ** |
(5,8± 1,2)·10-22 ***^ |
(3,6± 1,3)·10-22 ***^^$$ |
Примечание 1. M – среднее, m – средняя ошибка,
*- статистическая значимость отличия от 1 группы (* - p<0,05, ** - p<0,01, *** - p<0,0001);
^ - статистическая значимость отличия от 2-й группы (^ - p<0,05, ^^ - p<0,02, ^^^ - p<0,0001);
$ - статистическая значимость отличия от 3-й группы ($ - p<0,05, $$ - <0,02, $$$ - p<0,0001);
# - статистическая значимость отличия от 4-й группы (# - p<0,05, ##- <0,02, ### - p<0,0001).
Примечание 2. Величина дипольного момента рассчитывалась при напряженности электрического поля 8,85.10-12 Ф/м.
Сниженный поверхностный отрицательный заряд эритроцитов при тяжелом фиброзе F3, F4 отражался достоверно более низкими показателями скорости движения клеток к электродам и дипольного момента (p<0,001-0,05).
Исследование
взвесей эритроцитов методом терагерцовой спектроскопии выявило снижение уровней
амплитудного пропускания излучения на всех частотах диапазона у пациентов с диффузной
патологией печени по мере нарастания фиброза (p<0,001-0,05) (см. рис. 2). Причем,
спектроскопические показатели коррелировали со склонностью эритроцитов к
образованию агрегатов (r=0,68, p<0,02), преобладанием деформированных форм эритроцитов (r=0,77, p<0,04), сниженным дипольным моментом клеток (r=-0,64, p<0,01),
амплитудой деформации эритроцитов (r=-0,52, p<0,03) и емкостью мембран эритроцитов (r=0,49, p<0,05).
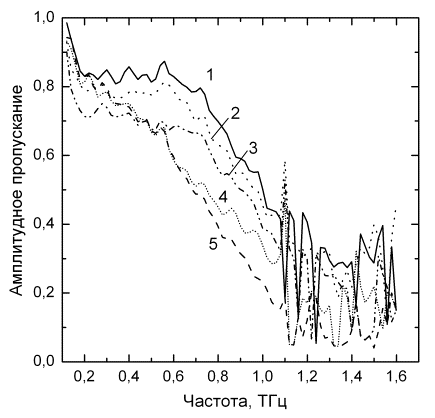
Рисунок 2. Типичные звисимости амплитуды пропускания ТГц
излучения слоями взвесей эритроцитов обследуемых в группах: F0 (1), F1 (2), F2 (3), F3 (4), F4 (5).
Исследование
эллипсометрических показателей тонких пленок, полученных из сывороток крови
пациентов с разными степенями фиброза печени, позволило установить факт достоверного
увеличения показателя преломления в сочетании со снижением толщины пленки,
усиления ее неоднородности, увеличение количества и глубины трещин, разрывов в
структуре тонкой пленки по мере нарастания фиброза (p<0,001-0,05)
(таблица 2, рис. 3).
Таблица 2. Эллипсометрические параметры тонких пленок,
полученных из сывороток крови, у больных
с диффузной патологией печени с разной степенью фиброза (M±m).
|
Эллипсометричес-кие показатели |
1
группа, стадия
фиброза F0 n=27 |
2
группа, стадия
фиброза F1 n=21 |
3 группа, стадия
фиброза F2 n=19 |
4 группа, стадия
фиброза F3 n=18 |
5 группа, стадия
фиброза F4 n=8 |
|
Толщина
пленки, d (нм) |
179,8+3,6 |
169,8+2,9* |
154,9+3,1*** |
143,5+3,3***^^$$ |
135,8+1,8***^^^$$$# |
|
Показатель преломления (l=632,8 нм) |
1,489+ 0,003 |
1,511+ 0,002*** |
1,529+ 0,004***^^^ |
1,538+ 0,002***^^^$ |
1,563+ 0,005***^^^$$$### |
Примечание: M – среднее, m – средняя ошибка, достоверность различий по группам, как в табл.1.
|
|
|
|
|
|
|
F0 |
F1 |
F2 |
F3 |
F4 |
Рисунок 3. Фотографии типичных тонких
пленок из сыворотки крови у пациентов с различными степенями фиброза.
Подобные
изменения могут быть связаны со снижением синтеза целого ряда соединений в
печени (в том числе, белков сыворотки крови, факторов свертывания, холестерина,
триглицеридов и др.) при выраженном фиброзе, которые являются определяющими для
толщины пленки (корреляции для уровней общего холестерина r=0,62, p<0,01;
триглицеридов r=0,53, p<0,03; общего белка r=0,60, p<0,04). Преобладание
неравномерных пленок при выраженном фиброзе, очевидно, связано с выраженностью
биохимического дисбаланса в сыворотке крови при циррозе печени. Показатель
преломления определяется в большей степени компонентами синдромов цитолиза (для
АЛТ r=0,52, p<0,02, для
АСТ r=0,44, p<0,05) и
холестаза (для общего билирубина r=0,57, p<0,01, для ГГТП r=0,52, p<0,02),
степень выраженности которых усиливается при выраженном фиброзе [7].
В спектрах
комбинационного рассеяния света (где регистрируются интенсивности пиков,
связанных с колебаниями отдельных молекулярных фрагментов, определяющих вторичную
структуру белков, липопротеинов) образцов жидких сывороток крови в области
750-1750 см-1 наблюдались три характерных пика поглощения: при 1005,
1157 и 1520 см-1, интенсивности которых оказались достоверно ниже
при наличии выраженного фиброза F3, F4 по сравнению с легким и умеренным (р<0,005-0,02) (таблица
3).
Таблица 3.
Площадь пиков комбинационного рассеяния света у больных с ДПП с различной
степенью фиброза (M+m).
|
Положение пика, см-1 |
1
группа, стадия
фиброза F0 n=27 |
2
группа, стадия
фиброза F1 n=21 |
3 группа, стадия
фиброза F2 n=19 |
4 группа, стадия
фиброза F3 n=18 |
5 группа, стадия
фиброза F4 n=8 |
|
1005 |
897 + 120 |
840 + 93 |
648+ 82* |
453+ 125**^^ |
351 + 94 ***^^^$ |
|
1157 |
2589 + 301 |
2257 + 215 |
1870 + 174* |
917 + 114***^^^ $$$ |
633 + 96***^^^$$$# |
|
1520 |
2997 + 150 |
2712 + 166 |
1987 + 173**^^^ |
862 + 110 ***^^^$$$ |
710 + 103 ***^^^$$$ |
Примечание: M – среднее, m – средняя ошибка, достоверность различий по группам, как в таблице1.
Интенсивности вышеописанных пиков оказались связанными с показателями липидного спектра
сыворотки крови, измененного пуринового обмена, нарушенной функцией почек. Это
согласуется с результатами исследования Tatarkovic M. еt al. [8] о
влиянии на выраженность данных пиков уровней липидов атеросклеротических
бляшек, каротиноидов [9]. Так, площадь пика при 1005 см-1 прямо
коррелировала с уровнем холестерина ЛПНП (r=0,74, p<0,04),
мочевой кислоты (r=0,62, p<0,05) и обратно – с уровнем ХС ЛПВП (r=-0,62, p<0,03). Площади
пиков при 1157 см-1, 1520 см-1 оказались связанными с
показателями, отражающими белоксинтетическую функцию печени, уровнем альбуминов(r=-0,74, p<0,02 для пика
при 1157 см-1), антитромбина
III и протеина
С (r=-0,88, p<0,05; r=0,73, p<0,01 для
пика при 1520 см-1). Возможно, полученные результаты объясняются
данными Rodia-Osornio
L.N. et al. [9], Camerlingo C. Et al. [10],
которые установили зависимость интенсивности пиков при 1157, 1520 см-1 от
количества С-С связей, выраженности деформационных колебаний С-ОН, уровней amid I молекул
протеинов.
Из эллипсометрических
показателей выявились обратные взаимосвязи показателя преломления с площадью
пика при 1157 см-1 (r=-0,75, p<0,04) и прямые – с толщиной пленки (r=0,63, p<0,001). С
неоднородностью пленок коррелировало отклонение пика при 1520 см-1 (r=0,54, p<0,03).
Обнаружены связи ряда вязкоупругих показателей эритроцитов с интенсивностями
пиков Раман-спектров. Так, амплитуда деформации клеток оказалась обратно
связанной с интенсивностью пика при 1005 см-1 (r=-0,65, p<0,03), а
обобщенная жесткость эритроцитов продемонстрировала с ней прямую связь (r=0,70, p<0,04).
Обобщенная вязкость коррелировала с интенсивностями пиков при 1001 см-1 (r=0,86, p<0,01).
Уровень гемолиза на высоких и низких частотах был связан с интенсивностью пика
1520 см-1 (r=-0,77, p<0,02 для 1 МГц; r=0,69, p<0,03 для 0,5
МГц; r=-0,54, p<0,05 для
0,1 МГц; r=-0,45, p<0,033 для 0,05 МГц).
Таким
образом, выявленные новые возможности оптических методов исследования крови, ее
отдельных компонентов являются весьма перспективными в диагностике,
разграничении степеней фиброза печени. Дальнейшие исследования в данном
направлении, возможно, в будущем, позволят верифицировать фибротический процесс
в печени на ранних стадиях и использовать совокупность данных методик в целях
скрининга и экспресс-диагностики степени фиброза печени.
Исследование
выполнено при поддержке Министерства образования и науки Российской Федерации,
соглашение 8041 от 24.08.2012, номер заявки «2012-1.1-12-000-1001-004»; при
частичной финансовой поддержке Минобрнауки РФ (ГК №02.740.11.0556), гранта РФФИ
11-02-12171-офи-м при использовании оборудования ЦКП СЦСТИ в рамках ГК № 16.552.11.7044
и при использовании оборудования научно-образовательного комплекса НГУ
«Наносистемы и современные материалы».
Литература:
1.
Ивашкин Н.Т. Болезни
печени и желчевыводящих путей. Руководство для врачей. Москва, М.: Вести. - 2002.
- 387С.
2. Ивашкин В.Т. Фиброз печени. М.: ГЭОТАР -Медиа.
2011. – 168С.
3. Курилович С.А., Кручинина М.В., Генералов В.М.,
Бакиров Т.С., Рихтер В.А., Семенов Д.В. Электрические параметры и структура
мембран эритроцитов при диффузных заболеваниях печени. // Российский журнал
гастроэнтерологии, гепатологии, колопроктологии. – 2009. – Том XIX. - №. 2 -
С.30-36.
4. Воевода М.И., Кручинина М.В., Пельтек С.Е.,
Курилович С.А., Кручинин В.Н., Спесивцев Е.В., Рыхлицкий С.В., Володин В.А.,
Генералов В.М., Герасимов В.В., Князев Б.А. Использование оптических методов
исследования крови в диагностике стадии заболевания при диффузной патологии
печени // Архив внутренней медицины. - 2012. – №.4. - С.46-54.
5. Воевода М.И.,
Кручинина М.В., Курилович С.А., Кручинин В.Н., Рыхлицкий С.В., Володин В.А.,
Пельтек С.Е., Кобзев В.Ф., Князев Б.А., Герасимов В.В. Диффузная патология
печени: что нового в диагностике степени фиброза? // Материалы VIII Международной научно-практической конференции «Aktualne problemy nowoczesnych nauk - 2012». – Vol.37. Medycyna: Przemysl. Nauka i studia. – 2012. – С.7-11.
6. Arwin H. Ellipsometry on thin organic layers of
biological interest: characterization and applications // Thin Solid Films. - 2000.
- V.377-378. - P.48-56.
7. Подымова
С.Д. Болезни печени. - М.: Медицина. - 1993. – 544С.
8. Tatarkovic M.,
Fisar Z., Raboch J., Jirak R., Setnicka V. Can chiroptical spectroscopy be used
for the analysis of blood plasma? // Chirality. – 2012. – V.6. – P.459-467.
9. Rocha-Osornio L.N.,
Pichardo-Molina J.L., Barbosa-Garcia O. et al. Chemamometric techniques on
the analysis of Raman spectra of serum blood samples of breast cancer patients
// Proc. of SPIE. – 2008. – V.6864. – P.16(1-7).
10. Camerlingo C., Zenone F.,
Perna G. et al. An investigation on micro-raman spectra and wavelet data analysis for
pemphigus vulgaris follow-up monitoring // Sensors. – 2008. – V.8. –
P.3656-3664.




