К.х.н.
Мазова О.В., Колодкина Ю.А.
Балтийский федеральный университет им.
И.Канта, Россия
СИНТЕЗ СОЕДИНЕНИЙ НА ОСНОВЕ ХАМАЗУЛЕНА И НЕКОТОРЫХ ХИНОНОВ
Хиноидные структуры широко распространены
в природе. Важной особенностью таких соединений является специфический характер
реакций и способность обменивать кольцевые заместители, не нарушая хиноидной
структуры. К свободным амино- и сульфгидрильным группам они легко
присоединяются и связываются с белками. Одним из важнейших свойств[1] является
их участие в редокс системах. Например, хиноны относятся к своеобразным
циклическим ненасыщенным дикетонам и являются переносчиками электронов в
дыхательных, фотосинтетических
биологических цепях. 1,4-Нафтохиноны можно рассматривать как аналоги
α,β-ненасыщенных кетонов с открытой цепью. Однако они обладают
большей реакционной способностью [1], чем
хиноны. Хамазулен, образованный из сесквитерпеновых
γ-лактонов в нативном растении, представляет один из основных компонентов эфирного масла,
обладающего биологической активностью.
При включении фармакофорных группировок в
биологически активную молекулу, обладающую комплексным действием, можно
получить новые вещества с иной активностью. Проведенные нами реакции интересны
еще и тем, что описание подобных соединений не встречается в литературе.
Представители семейства сложноцветных (сompositae)
широко распространены в растительном мире. Они отличаются большим разнообразием
видов, высокой устойчивостью к воздействию внешних факторов. Это позволяет
предположить наличие в таких растениях развитой системы биосинтеза веществ
вторичного метаболизма с разноплановыми защитными функциями. В связи с этим
представители семейства сompositae включены в реестр лекарственных растений
[2], обладающих свойствами активизировать фагоцитарные функции организма,
бактерицидным, кровоостанавливающим и противовоспалительным действием.
Фенольные соединения,
полисахариды, витамины, эфирные масла представляют биологически активный
комплекс тысячелистника обыкновенного (Achillea millefollium L.).
Известно о химической изменчивости эфирного масла тысячелистника
обыкновенного. В его составе обнаружено 50 компонентов [3], в том числе азулены,
сложные эфиры, камфора, туйол, цинеол, кариофиллен.
В проведенных синтезах п-бензохинон,
хлоранил, окись нафтохинона, аддукт антрацена и малеинового ангидрида были получены и очищены по ранее
отработанным методикам [4]: 1,4-бензохинон - окислением
гидрохинона броматом калия в кислой
среде (выход 75%, т.пл. 120ºC); 2,3,5,6-тетрахлорбензохинон
(хлоранил) – окислительным хлорированием п-фенилендиамина с хлоратом калия и
хлорводородной кислотой (выход 70%, т.пл. 278оС); 1,4-нафтохинон - окислением нафталина бихроматом
калия и серной кислотой (выход 68%
,т.пл. 124ºС); затем, методом Вейтса [5], нафтохинон окисляли пероксидом
водорода до окиси 1,4-нафтохинона
(выход 55% ,т.пл.133ºС); аддукт антрацена и малеинового ангидрида
получали диеновым синтезом Дильса-Альдера в среде ксилола, который
очищали перекристаллизацией из ледяной уксусной кислоты (выход 58% ,
т.пл.303ºС).
Используя классическую
методику перегонки с паром, получали эфирное масло соцветий тысячелистника
обыкновенного (Achillea millefollium L.). По окончании отгонки [3], в перегонную колбу вводили
петролейный эфир, как низкокипящий органический растворитель. Метод гидродистилляции
известен как доступный и высокоэффективный способ выделения летучих веществ. А
выделение окрашенного в синий цвет хамазулена, одного из основных биологически
активных [2,3] компонентов эфирного масла тысячелистника, можно визуально
контролировать.
Нами были подготовлены морфологически идентичные соцветия
тысячелистника обыкновенного. Сбор производился в период цветения с июня по
сентябрь в одном регионе Калининградской области. Все образцы сушили и хранили
в одинаковых условиях в соответствии с правилами сбора и сушки лекарственных
растений [6].
Для получения эфирных масел,
из рабочей колбы с водой и соцветиями, отгоняли дистиллят. По окончании
гидродистилляции в рабочую колбу через капельную воронку вводили петролейный
эфир. Пар пропускали до полного перехода растворителя в приемник. Полученный
дистиллят экстрагировали, эфирную вытяжку сушили безводным сульфатом натрия,
отгоняли растворитель и получали масло темно-синего цвета из-за присутствия в
нем хамазулена. Известно, что эфирные
масла тысячелистника (Achilea
sp.) [7] представлены, главным образом, монотерпенами и сесквитерпенами.
Содержание отдельных составляющих изменяется в пределах от десятков процентов
до десятых и сотых долей процента. Реальное
количество веществ, продуцируемых растениями, больше, если учитывать те, которые содержатся в очень малых
количествах и могут быть обнаружены по мере применения более чувствительных
методов. Общий состав минорных
компонент эфирных масел непостоянен. Однако
из набора терпеноидов эфирных масел можно исключить высоко летучие
монотерпеноиды, которые теряются при сушке и пробоподготовке. Вследствие этого,
наиболее подходящими соединениями для хемотаксономии тысячелистника являются
сесквитерпеноиды. Хроматограммы эфирных масел, изученных
нами образцов тысячелистника, были характерными, похожими и достаточно стабильными.
Группа мажорных соединений представлена:
кариофилленом (I), гермакреном (II) и хамазуленом (III), которые и можно считать хемотаксоном тысячелистника
обыкновенного (схема). Хамазулен,
являющийся норсесквитерпеном, в нативном виде в растении не содержится, а
образуется в ходе гидродистилляции как результат термического разложения
ахиллицина (IV) и матрицина (V) и подобных, присутствие которых в экстрактах
тысячелистника было ранее установлено [8]
(тех, которые могут образовать ароматическую систему азулена
элиминированием фрагментов воды, углекислоты и карбоновой кислоты).
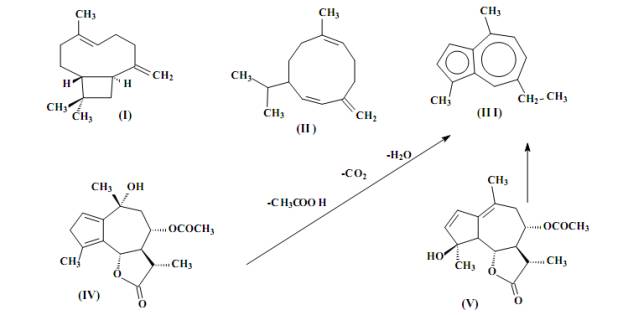
Хамазулен обладает интенсивной голубой
окраской (λmax =595 нм, ε~ 33000)
и всегда заметен визуально даже в незначительных концентрациях.
Из концентрата эфирных масел нами был выделен основной
компонент - хамазулен - методом адсорбционной хроматографии на колонке,
заполненной силикагелем. Идентичность его подтверждали ИК-спектрами.
Взаимодействие эквимольных количеств хамазулена и хинонов
осуществлялось в этаноле при нагревании в течение часа и механическом
перемешивании. Осадки, образующиеся в результате реакций, отделяли декантацией
и промывали безводным этиловым спиртом. Продукты синтеза сушили в эксикаторе,
заполненном предварительно прокаленным хлоридом кальция.
В реакции сочетания хамазулена с
п-бензохиноном образуются коричневые кристаллы 1,4-дигидрокси-2-(3-хамазуленил)-бензола.
(Выход 64%. Т.пл. 281-283о). Как известно, взаимодействие в природе
с карбонильными соединениями предпочтительнее происходит путем образования
полуацеталей или ацеталей. Результаты ИК-спектров не противоречат
предполагаемым структурам.
При взаимодействии хлоранила
(2,3,5,6-тетрахлорбензохинона) с хамазуленом наблюдали образование бордового
комплекса с переносом заряда, что характерно для подобных соединений. Однако
этот семихинон неустойчив и через некоторое время распадается на исходные вещества
– хамазулен и хлоранил. (Т.пл. 278,7оС). Это подтверждается ИК-спектром.
Синтез соединений на основе хамазулена и
окиси нафтохинона проводился в двух температурных режимах. Взаимодействие в
интервале 200-220оС приводит к изомеризации хамазулена в крупные
пластинчатые кристаллы нафталина при более низкой температуре, чем известно
[9]. А при 100-120оС образуются крупные кристаллы 1,3,4 –
тригидрокси-2-(3-хамазуленил)- нафталина коричневого цвета. (Выход 70%. Т.пл.670С).
Соединение, образованное на основе реакции
диенового синтеза хамазулена с аддуктом антрацена и малеинового ангидрида,
представляет собой крупные блестящие кристаллы серого цвета
2,3-(9,10-дигидроантрил)-(3-хамазуленил)-сукцината. (Выход 60%.Т.пл. 193,8-195 0С).
Функционально-групповой анализ полученных
соединений был проведен с помощью характеристических полос поглощения в
ИК-спектрах, которые показывают для полученных соединений колебания связей
групп С-ОН, Аr-Н, С-C1, С-СН3,
С(О)-О- валентные колебания С=С в бензольных кольцах и азулене.
Результаты проведенных качественных реакций, элементный анализ, данные
ИКС не противоречат предложенным структурам полученных соединений.
Температуры плавления веществ определяли
стандартным капиллярным методом [10].
Литература:
1.
Кутырев
А.А., Москва В.В. Нуклеофильные реакции хинонов. // Успехи химии, т.60, вып.1, 1991г.,
С.163-167.
2.
Атлас ареалов и ресурсов лекарственных растений СССР, М.,
1980.
3. Палей Р.В., Племенков В.В., Артемов Н.П., Чугунов
Ю.В., Фазлыева М.Г. Химический состав эфирного масла Achillea millefolium L.,
полученного методом гидродистилляции // Растительные ресурсы. 1996. Т. 32. Вып.
4., С. 37–44.
4.
Мазова О.В.
Органическая химия. Практикум. – Калининград, Изд. КГУ, 2002 г., 56 с.
5. Weitz E., Schobbegt H.,
Siebert H. Ber., 1955,
68, P.1163
6.
Правила
сбора и сушки лекарственных растений. Сборник инструкций, 1985 г.
7. Растительные ресурсы СССР. Цветковые растения, их
химический состав, использование; семейство Asteraceae (Compositae). СПб, 1993,
С. 352.
8. Куцик Р.В., Зузук Б.М. Тысячелистник обыкновенный
Achillea millefolium L. (Аналитический обзор) // Провизор. 2002. № 15. С.
34–38.
9.
Березин
Б.Д., Березин Д.Б. Курс современной органической химии. М., Высш. шк., 1999,
С.69-77
10. ГОСТ
18995.4-73 Методы определения интервала температур плавления. – М. ИПК
Издательство Стандартов. 1974