Химия и химические технологии / 6.Органическая химия
Ст. преп. Леденёва О.П.1, к.х.н. Авдеенко А.П.2, к.х.н. Коновалова С.А.2
1Украинская
инженерно-педагогическая академия, Украина
2Донбасская
государственная машиностроительная академия, Украина
Синтез 6-ГИДРОКСИ-2-МЕТИЛ(АРИЛ)-
1,3-БЕНЗОКСАЗОЛОВ
В настоящей работе
предложен довольно простой метод получения
6-гидрокси-2-метил(арил)-1,3-бензоксазолов. Согласно литературным данным
1,3-бензоксазолы могут быть получены на основе галогенсодержащих
2-бензамидоантрахинона [1], 1,4-нафтохинона [2], при бромировании
2,4-диацетиламинофенол [3].
Ранее в результате галогенирования различных N-ацетил(ароил)-1,4-бензохинонмоноиминов
получены соответствующие галогенсодержащие хинонмоноимины и аминофенолы [4, 5],
которые могут быть использованы как исходные вещества для синтеза
1,3-бензоксазолов.
Эксперимент показал, что 1,3-бензоксазолы (VIII–XIII)
могут быть получены в результате действия брома с соотношением реагент–бром,
1:5, в хлороформе на галогенсодержащие N-ацетил(ароил)-1,4-бензохинонмоноимины
(I–VII), которые имеют только одно свободное орто-положение по отношению к иминному
атому углерода
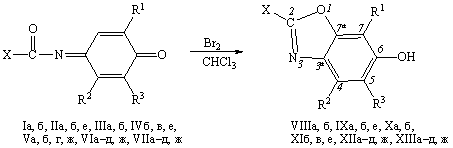
I,
VIII,R1 = Me, R2 = R3 = Cl; II, IX, R1
= Me, R2 = R3 = Br; III, X, R2 = Me, R1 = R3
= Cl; IV, XI,R2 = Me, R1 = R3 = Br; V, R2
= Me, R1 = i-Pr, R3 = H; VI, XII,R2
= Me, R1 = i-Pr, R3 = Cl; VII, XIII,R2
= Me, R1 = i-Pr, R3 = Br; X = C6H5 (а), 4-МеC6H4 (б), 4-ClC6H4
(в), 4-NO2C6H4 (г), 3-NO2C6H4 (д), 4-Br-3-MeOC6H3 (е),
Me (ж).
Бромирование в других растворителях (ДМФА, АсОН,
смесь ДМФА-АсОН), с другим соотношением реагентов и хлорирование при любых
условиях приводит либо к галогенированию хиноидного ядра, либо выделяются
исходные хинонмоноимины.
Бензоксазолы (XVа, б) были также
получены при бромировании в аналогичных условиях 4-ароилимино-2,6-ди-трет-бутил-5,5,6-трихлор-2-циклогексен-1-онов
(XIVа, б), которые являются продуктами хлорирования N-ароил-2,6-ди-трет-бутил-1,4-бензохинониминов [5].
Причем в конечном продукте (XV) присутствует только
одна трет-бутильная группа. Подобное
замещение трет-бутильной группы
наблюдалось ранее при хлорировании 4-амино-N-ароил-2,6-ди-трет-бутилфенолов [5] и в реакции
2,6-ди-трет-бутил-1,4-бензохинон-4-оксима с S2Cl2 в присутствии N-этилдиизопропиламина
и N-хлорсукцинимида в тетрагидрофуране [6].
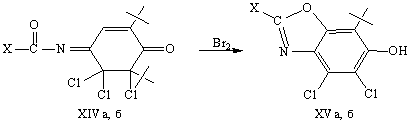
X = C6H5 (а), 4-МеC6H4
(б).
Состав и строение синтезированных бензоксазолов
(VIII–XIII, XV) доказаны с помощью данных элементного анализа, ИК, ЯМР 1Н
и ЯМР 13С спектроскопии и РСА.
Ранее [7] предполагалось, что при получении
бензоксазолов на основе галогенсодержащих соединений на первом этапе происходит
протонирование атома азота, а затем уже замыкание цикла. Но в настоящей работе
бромирование хинонмоноиминов (I–VII)
проводили в апротонном растворителе. На основании выполненного эксперимента и проведенных
ранее иследований [4, 5] можно предположить, что при бромировании
хинонмоноиминов (I–VII) вначале происходит
образование бромониевого иона с последующим превращением в карбокатион, для
которого в хлороформе более выгодным становится замыкание цикла и образование бензоксазола.
Литература:
1. Ullmann F., Junghans W. Lieb. Ann. Chem. 1913, Bd. 399, S. 330–345.
2. Fries K., Ochwat P. Ber. 1913,
Bd. 56, S. 1291–1304.
3. Heller
G. J. Prakt. Chem. 1931, V. 129, P. 211–257.
4. Авдеенко
А.П., Коновалова С.А., Лудченко О.Н., Паламарчук Г.В., Шишикин О.В. ЖОрХ. 2009,
T. 45, Вып. 11, C. 1660–1670.
5. Авдеенко
А.П., Пироженко В.В., Шишкин О.В., Паламарчук Г.В., Зубатюк Р.И., Коновалова
С.А., Лудченко О.Н. ЖОрХ. 2008, Т. 44, Вып. 6, С. 818–824.
6. Polo C., Ramos V., Torroba T. Tetrahedron. 1998,
N 54, P. 223–232.
7. Adams
R., Stewart J.M. J. Am.Chem.Soc. 1952, V. 74, N 14, P. 3660–3664.