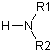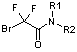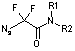Химия и химические технологии / Органическая химия.
Поливанова А.Г., Раимов Д.Р., Мельникова Е.С.
Российский химико-технологический
университет им. Д.И. Менделеева, Москва, Россия
Синтез новых
соединений в ряду α,α-дифторазидов и исследование их взаимодействия с
первичными аминами в условиях микроволнового облучения
В настоящее время синтез новых гетероциклических
структур с потенциальной биологической активностью является одним из важнейших
направлений в органической химии. Расширение библиотек новых биологически
активных соединений определяет постоянное усложнение структур синтезируемых
веществ, ввиду чего весьма актуален поиск новых эффективных методов их синтеза.
С другой стороны, в области химии биологически активных веществ большое
внимание уделяется синтезу аналогов известных биологически активных структур,
модифицированных атомами фтора, а также получению синтетических
гетероциклических производных различных классов биогенных веществ.
α,α-Дифторазиды (RCF2N3) – являются стабильными и безопасными соединениями,
которые легко получать из фторолефинов или фторгалогенидов [1-3]. Ранее на
примере нескольких представителей данного класса было показано, что эти
соединения могут быть использованы как реагенты для синтеза четырех типов
гетероциклических структур: 1,5‑дизамещенных тетразолов, 1,2,3-триазолов,
3-фторизохинолинов и замещенных пиридинов (схема 1) [4-7].
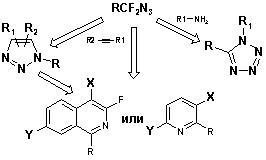
Схема 1
Продолжая начатые исследования в области
α,α-дифторазидов, мы синтезировали несколько новых представителей данного
класса соединений и изучили их некоторые химические свойства.
Синтез производных бром(дифтор)уксусной кислоты общей формулой N3CF2CONR1R2 осуществлялся по уже отработанной методике [3] посредством двухстадийного синтеза, где в качестве исходных соединений использовали коммерчески доступные бром(дифтор)ацетаты (схема 2).
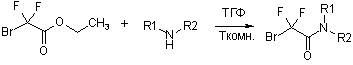
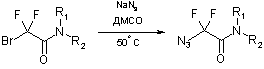
Схема 2
Согласно данной схеме, метил- или этилбром(дифтор)ацетаты
амидировали вторичными аминами при комнатной температуре и полученные таким
образом бром(дифтор)ацетамиды далее вводили во взаимодействие с азидом натрия при
50 °С, получая целевые азидо(дифтор)ацетамиды с выходом более 70%. В
качестве исходных аминов в данном исследовании были выбраны пирролидин,
пиперидин и метилпиперазин (табл.1).
Табл.1 Выходы продуктов при синтезе
2-азидо-2,2-дифторацетамидов
|
|
Выход, % |
|
|
|
|
|
|
|
90 |
72 |
|
|
90 |
80 |
|
|
98 |
75 |
С целью расширения ряда новых α,α-дифторазидов
в качестве целевых продуктов нами были выбраны соединения принципиально нового
строения. В литературе представлены данные о синтезе бром- и хлор(дифтор)ацетофенонов
[7-8], причем замещение брома или хлора на азидную группу в подобных структурах
ранее описано не было. В данном исследовании нами впервые был реализован синтез
азидо(дифтор)ацетофенонов по следующей схеме:
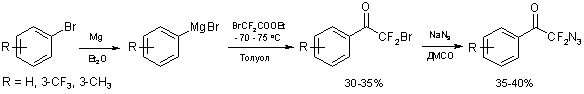
Схема 3
Полученные по классической методике арилмагнийбромиды
вводили во взаимодействие с этилбром(дифтор)ацетатом в толуоле при -70 – -75 оС,
в результате чего с невысокими выходами были синтезированы соответствующие бром(дифтор)ацетофеноны.
Далее в полученных соединениях проводили замещение брома на азидную группу
взаимодействием с азидом натрия в диметилсульфоксиде при 50 оС,
и в результате целевые азидо(дифтор)ацетофеноны были получены с выходом 35 –40 %.
Суммарный выход продуктов при реализации данной схемы составил 10 – 15 %.
С целью увеличения общего выхода целевых α,α-дифторазидов нами проведена оптимизация методики синтеза бром(дифтор)ацетофенонов. В качестве модельного соединения для отработки данной стадии был выбран бромбензол. Кроме этилбром(дифтор)ацетата в качестве исходных соединений использовали также метилбром(дифтор)ацетат и бром(дифтор)уксусную кислоту [9]. В реакции варьировали также температуру, растворитель и соотношение исходных реагентов (схема 4).
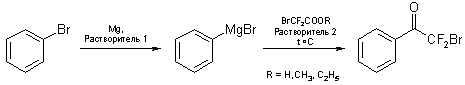
Схема 4
Результаты исследования представлены в таблице 2.
Табл. 2. Оптимизация условий синтеза 2-бром-2,2-дифтор-1-фенилэтанона
|
№ |
R |
Раство-ритель 1 |
Раство-ритель 2 |
t , oC |
PhMgBr : BrCF2COOR |
Выход, % |
|
1 |
С2Н5 |
Et2O |
Толуол |
-70 – -75 |
1: 1,2 |
35 |
|
2 |
СН3 |
Et2O |
ТГФ |
-70 – -75 |
1: 1,2 |
40 |
|
3 |
СН3 |
Et2O |
Толуол |
-70 – -75 |
1: 1,2 |
30 |
|
4 |
Н |
ТГФ |
ТГФ |
-10 – -15 |
1: 1,2 |
23 |
|
5 |
Н |
ТГФ |
ТГФ |
-10 – -15 |
3 : 1 |
30 |
|
6 |
Н |
Et2O |
Et2O |
-10 – -15 |
3 : 1 |
45 |
Таким образом, наибольший выход целевого продукта был
получен при использовании в качестве растворителя диэтилового эфира и трехкратного
мольного избытка фенилмагнийбромида по отношению к бром(дифтор)уксусной
кислоте.
Как показано ранее [1], α,α-дифторазиды
можно получать из перфторированных и полифторированных олефинов в виду того,
что они проявляют повышенную реакционную способность в реакциях присоединения
нуклеофилов. Данная методика включает в себя использование различных спиртов в
качестве растворителей, причем авторы рекомендуют использовать высококипящие
спирты, что снимает трудности при отгонке целевых азидов от побочных
фторированных простых эфиров.
Для синтеза нового α,α-дифторазида по данной
схеме был выбран коммерчески доступный пентафтораллилфениловый эфир, в качестве
растворителей использовали изопропанол и 1-метокси-2-пропанол (схема 5).
Проведение реакции в среде 1-метокси-2-пропанола позволяет достичь более высокого
выхода целевого азида, хотя процедура выделения в обоих случаях является
достаточно трудоемкой и включает двухкратную перегонку реакционной массы и
дальнейшее хроматографическое разделение азида и соответствующего
фторированного простого эфира.
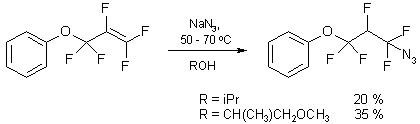
Схема 5
Наибольший интерес среди химических свойств
α,α-дифторазидов представляет их реакция с первичными алифатическими
аминами, в ходе которой образуются соответствующие 1,5‑дизамещённые
тетразолы [5,6] (схема 6).
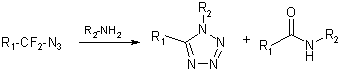
Схема 6
Было установлено, что данная реакция протекает в
мягких условиях: при комнатной температуре или при кипячении в абсолютном
этаноле или тетрагидрофуране. Побочным продуктом является соответствующий амид.
Основным недостатком разработанного метода синтеза тетразолов является
длительное время протекания реакции (для некоторых азидов свыше 10 часов) и невысокий
выход целевого тетразола в случае использования в качестве исходных реагентов
стерически затрудненных аминов и аминов с низкой нуклеофильностью.
С целью оптимизации условий синтеза 1,5‑дизамещенных
тетразолов нами проведены исследования протекания данной реакции в условиях
микроволнового облучения на примере некоторых a,a‑дифторазидов (схема 7).
Реакции проводили на приборе CEM Discower в закрытых
сосудах объемом 10 мл, мощность излучения варьировали в диапазоне 50 - 80 Вт,
температуру варьировали в диапазоне Tкип. растворителя – 130 °C, в качестве растворителей использовали абсолютный
этанол и тетрагидрофуран.
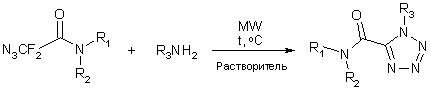
Схема 7
Результаты исследования
представлены в таблице 3.
Табл. 3. Синтез 1,5-дизамещенных тетразолов из a,a‑дифторазидов в условиях микроволнового облучения
|
R1, R2 |
R3 |
Раство-ритель |
t, °С |
PMW, Вт |
τ |
Выход, % |
|
|
CH2CH2N(Et)2 |
EtOH(абс.) |
tкип. |
80 |
7 ч |
28 |
|
120 |
1 ч. 30 мин. |
37 |
||||
|
ТГФ |
tкип. |
8 ч. 20 мин. |
25 |
|||
|
120 |
3 ч. 30 мин. |
30 |
||||
|
EtOH(абс.) |
140 |
50 |
50 мин. |
38 |
||
|
ТГФ |
140 |
50 |
1 ч. |
30 |
||
|
|
Et |
EtOH(абс.) |
130 |
50 |
40 мин. |
45 |
|
|
|
EtOH(абс.) |
130 |
50 |
40 мин. |
30 |
τ – время протекания реакции
На основании проведенной
серии опытов мы установили, что выход целевого тетразола практически не зависит
от температуры взаимодействия. При использовании в качестве растворителя
абсолютного этанола выход тетразола оказывается несколько выше, чем при
использовании тетрагидрофурана. Мощность микроволнового излучения не оказывает
влияния на выход целевого продукта и время взаимодействия.
Наибольшее влияние на
скорость протекания реакции оказывает температура нагрева и, соответственно,
давление внутри реакционного сосуда. При проведении реакций при температуре до
120 °C (избыточное
давление в системе составляет менее 1,3 атм) скорость взаимодействия
существенно зависит от используемого растворителя и в абсолютном этаноле оказывается
в два раза выше, чем в тетрагидрофуране. При увеличении температуры реакции свыше
130 °C и, соответственно, избыточного давления в системе свыше
1,5 атм время взаимодействия значительно сокращается и практически не зависит
от растворителя, в среде которого протекает реакция.
Таким образом, в результате
проведенной серии опытов нами установлено, что оптимальным условием для
получения тетразолов по представленной выше схеме является проведение реакции в
закрытом сосуде при температуре 130 – 140 °C и избыточном давлении выше 1,3 атм. Эта методика
позволяет сократить время взаимодействия с 7 – 8 часов до 50 минут, однако
практически не сказывается на выходе целевого продукта.
Таким образом, в ходе данного исследования синтезированы новые представители в ряду a,a‑дифторазидов, проведена работа по оптимизации методик их синтеза, а также изучены закономерности протекания реакции a,a‑дифторазидов с первичными алифатическими аминами в условиях микроволнового облучения.
Литература:
1. 2-Hydroperfluoropropyl
azide – a versatile reagent for the oxidative fluorination of organic compounds
of trivalent phosphorus/ S. A. Lermontov, I. I. Sukhojenko, A. V. Popov, A. N.
Pushin, I. V. Martynov, N. S. Zefirov, P. J. Stang..// Heteroatom Chemistry. -1993. – V. 4, – №6. – P. – 579-585.
2. P. 4576752 США b-Substituted
polyfluoroethyl compounds.
3.
Лермонтов С.А.,
Поливанова А.Г., Шкавров С.В. Взаимодействие α,α‑дифторазидов
с соединениями трехвалентного фосфора и трифенилсурьмой // Журнал общей химии.
– 2010. – вып. 8 – С. 1335-1340.
4. Lermontov S. A.,
Shkavrov S. V., Pushin A. N.. The reaction of a,a-difluoroazides with
acetilenic compounds. // J. of Fluorine Chem. – 2000. – V. 105, P. – 141-147.
5. Novel Synthesis of
1,5-Disubstituted Fluorinated Tetrazoles from 1,1-Difluoroazides/ Polivanova
A.G., Shkavrov S.V., Churakov A.V., Lermontov A.S., Lermontov S.A. //
Tetrahedron Letters. – 2010. – Vol. 51 – P. 4205-4207.
6. Synthesis of
1,5-Disubstituted Fluorinated Tetrazoles/ Polivanova A.G., Shkavrov S.V.,
Churakov A.V., Lermontov A.S., Lermontov S.A. // Synfacts. – 2010. – V. 10 – P.
1124.
7.
Synthesis of nitrogencontaining heterocyclic compounds from
alfa,alfa-difluoroazides/ Polivanova A.G., Raimov D.R., Melnikova E.S., Lermontov
S.A., Shkavrov S.V. // Chemistry of Nitrogen Containing Heterocycles, CNCH-2012
abstracts (12.11.2012 – 16.11.2012; Kharkov). – Kharkov, 2012. - P17
8. Takashi Yamazaki,
Tsukasa Terajima, Tomoko Kawasaki-Taskasuka. Unusual reactions of Grignard
reagents toward fluoroalkylated esters.// Tetrahedron. – 2008.– V.64 – P. 2419.
9.
Zai-Ming Qui, Donald J. Burton. Synthesis of α,α-Difluoro-Functionalized
Ketone.// J. Org. Chem. – 1995. – V. 60. – P. 5570 – 5578.