Медицина /2.
д.т.н., проф. Родионов И.В.
Саратовский государственный технический
университет имени Гагарина Ю.А., Россия
Технология формирования микро- и наноструктурированных биосовместимых
покрытий на основе титанооксидной керамики
Статья
подготовлена при поддержке Гранта РФФИ «а» № 13-03-00248
В восстановительной медицине широко
применяются достижения современной имплантологии, ориентированные на разработку
биотехнических систем, позволяющих полностью восстанавливать нарушенные либо
утраченные функции организма. К числу наиболее распространенных направлений
применения данных систем относятся травматология, ортопедия и челюстно-лицевая
хирургия, где с помощью металлических имплантационных конструкций (имплантатов)
осуществляется лечение различных костных патологий опорно-двигательного
аппарата и челюстно-лицевого отдела.
Ортопедические
и стоматологические имплантаты функционируют в организме, испытывая влияние
факторов биологических сред и тканей, включающих физико-химическое воздействие
и механические нагрузки. Для придания имплантатам наилучших качеств
взаимодействия с окружающими биоструктурами при исключении опасности
возникновения воспалительных процессов и реакций отторжения материалы
имплантатов должны обеспечивать проявление их высокой биосовместимости и
остеоинтеграционной способности поверхности. С этой целью при изготовлении
имплантатов наиболее часто
применяются титан и сплавы на его основе,
обладающие биоинертностью и не
вызывающие токсикологических реакций в организме. На
титановые медицинские имплантаты наносятся микро- и нанопористые покрытия из биокерамических материалов, создающих
наилучшие биотехнические условия для протекания остеоинтеграционных процессов
на поверхности имплантатов.
Материалами таких покрытий выступают различные вещества,
не оказывающие токсикологического действия и не вызывающие иммунных процессов в
окружающих тканях и жидких средах организма – кальцийфосфатные соединения,
углерод, оксиды биоинертных металлов и др. [1-4].
За счет придания покрытиям высокой степени шероховатости,
определенной пористости, развитой морфологии и структурной гетерогенности достигаются
условия интеграции с костной тканью, когда костные клетки прорастают в
имеющиеся открытые микропоры и неровности поверхности, создавая прочное
закрепление имплантатов в организме.
Перспективными материалами биосовместимых
остеоинтеграционных покрытий являются нетоксичные металлооксидные соединения,
получаемые на поверхности титановых имплантатов методом газотермического
оксидирования на воздухе. Преимущество данного метода получения биосовместимого
оксидно-керамического покрытия от других применяемых методов состоит в технологической
простоте реализации процесса, в отсутствии необходимости использования
дополнительных материалов для покрытия, в возможности проведения групповой
обработки имплантатов.
Наибольшее
применение технология газотермического
оксидирования нашла при структурообразовании и модифицировании поверхности титановых (ВТ6, ВТ16) чрескостных
имплантатов для травматологии и ортопедии. При этом в качестве реакционной
технологической среды используется атмосфера воздуха, в результате нагрева
которой в электропечи с размещенными имплантатами происходит образование на
поверхности изделий пленочного оксидного покрытия из нетоксичных титанооксидных соединений субмикронного и
нанокристаллического строения. Для обеспечения высокой пористости и
морфологической гетерогенности структуры оксидной матрицы поверхность
имплантатов предварительно обрабатывают с использованием способа
воздушно-абразивной обдувки мелкодисперсными частицами электрокорунда Al2О3,
чем создается исходно выраженная микрошероховатость и развитая геометрия
рельефа оксидируемой поверхности. Поэтому при воздушно-термическом
оксидировании имплантатов с такими исходно гетерогенными поверхностями
происходит разнонаправленный рост оксидных кристаллов и формирование
сложноориентированных элементов морфологии покрытия. Такой характер
структурообразования оксидных пленочных систем на титановых имплантатах позволяет получать высокопористые оксидные матрицы
с развитым рельефом для эффективного интеграционного взаимодействия с костной
тканью, при котором костные клетки прорастают в имеющиеся поры и углубления
покрытия, обеспечивая повышенную прочность сцепления поверхности имплантатов с
прилегающей костью.
После воздушно-абразивной
обдувки микрошероховатые титановые имплантаты обрабатывают с использованием метода ультразвуковой очистки в моющем растворе
40 г/л Na3РО4
в течение 25-30 мин при частоте ультразвуковых колебаний f=22 кГц и интенсивности W=1,2 Вт/см2
для удаления загрязнений различной химической природы,
которые могут являться хорошей питательной средой для микроорганизмов.
Затем
предварительно подготовленные имплантаты подвергают нагреву в электропечи
сопротивления с протеканием процесса оксидирования на воздухе при температурах в
печи 500- 6000С с
выдержкой 1,0 ч. При этом после нагрева имплантатов в электропечи в течение
каждых 10 мин осуществляется их
кратковременное охлаждение с извлечением из печи на 5-10 сек.
Формирование и
структурообразование титанооксидных
покрытий при многократных термических циклах «нагрев-охлаждение» имплантатов на воздухе характеризуется растрескиванием (фрагментацией)
частиц оксидов с получением керамических
покрытий, имеющих гетерогенную трещиноватую микро- и наноструктуру, что
существенно повышает
остеокондуктивные качества и геометрическую биоактивность оксидированных титановых поверхностей.
Рентгенофазовыми исследованиями установлено, что при
оксидировании имплантатов из титана марок ВТ1-0 и ВТ1-00 значения межплоскостного расстояния d при различной величине
интенсивности дифракционных линий J соответствуют
присутствию в полученном покрытии
наибольшего количества фаз титана и его диоксида TiO2 с наличием весьма малого
содержания низших оксидов Ti2O3 и Ti3O5 (рис. 1).
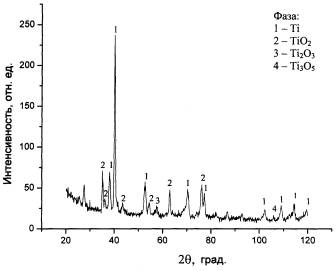
Рис. 1. Дифрактограмма титанооксидного керамического покрытия, полученного воздушно-термическим оксидированием титановых имплантатов при многократных термических циклах
«нагрев-охлаждение» при t=5000С и τ=1,0 ч (охлаждение в течение 5-10 сек через
каждые 10 мин нагрева)
Полученный фазовый состав покрытий включает биоинертные
титанооксидные соединения, которые, образуя механически прочную матричную
структуру, могут с высокой эффективностью применяться в качестве функциональных
поверхностных слоев чрескостных и внутрикостных титановых имплантатов.
В технологических условиях воздушно-термического
оксидирования имплантатов при многократных
термических циклах «нагрев-охлаждение» на поверхности образуются частицы оксидов титана, которые за счет осуществления
указанных термических циклов
вследствие быстро изменяющихся внутренних напряжений растрескиваются с разрывом
связей между частицами и керамическое
покрытие приобретает трещиноватую микро- и наноструктуру. Так,
морфологическая структура покрытий характеризуется наличием множества
разноориентированных выступающих частиц и открытых пор, распределенных по
поверхности с различной равномерностью (рис. 2). Характер
такого распределения частиц и пор покрытия, а также их размерные показатели
обусловливают высокую гетерогенность поверхностной структуры полученного титанооксидного покрытия, что благоприятно влияет на процесс
остеоинтеграции оксидированных имплантатов, при котором костные клеточные
структуры имеют возможность прорастать в микронеровности покрытия.

Рис. 2.
Монохроматическое изображение структуры
титаноооксидных керамических покрытий, полученных на титане ВТ1-00 при различных температурах
воздушно-термического оксидирования и продолжительности 1,0 ч (с учетом осуществления многократных термических
циклов «нагрев-охлаждение»)
(белые поля – частицы, черные поля – поры и
углубления)
Результаты лабораторной
апробации имплантатов in vivo (на кроликах) из титана ВТ1-00 с воздушно-термическими покрытиями на основе микро- и наноструктурированной титанооксидной керамики показали, что в течение
50 суток функционирования образцов в большеберцовых костях
животных поверхность титанооксидного
покрытия интегрировалась с
окружающей костной тканью и прочно срослась
с биоструктурами. При извлечении образцов было отмечено присутствие на их
поверхности крупных фрагментов новообразованной кости, прочно соединенной с
морфологически гетерогенным покрытием (рис. 3). Это свидетельствует о существенном влиянии созданных микро- и
наноструктурированных покрытий на остеокондуктивность поверхности титановых имплантатов и их способность
прочно срастаться с костными структурами.

Рис. 3. Микроизображения
поверхности титанового имплантата с экспериментальным оксидным покрытием после
теста in vivo (50 суток): а –
винтовая часть имплантата с костными фрагментами (х142); б – участок поверхности, покрытый костной тканью
(х300); в - участок поверхности, покрытый костной тканью
(х978); г - участок поверхности, покрытый костной тканью
(х5000)
Таким
образом, эксперименты на лабораторных
животных показали, что полученные покрытия
на основе микро- и наноструктурированной титанооксидной керамики
обеспечивают прочное срастание поверхности имплантатов с костной тканью и
обладают высокой остеоинтеграционной способностью. Разработанные покрытия могут быть рекомендованы для использования на титановых чрескостных и внутрикостных имплантатах, применяемых
при лечении переломов костей опорно-двигательного аппарата и в восстановлении функций зубных рядов.
Литература
1. Биосовместимые материалы:
Учебное пособие / Под ред. В.И. Севастьянова, М.П. Кирпичникова. М.: ООО
«Медицинское информационное агентство», 2011, 544 с.: ил.
2. Штильман М.И. Полимеры
медико-биологического назначения. М.: ИКЦ «Академкнига», 2006, 400 с.
3. Бейдик О.В., Бутовский К.Г., Островский
Н.В. и др. Моделирование наружного чрескостного остеосинтеза. Саратов: Изд-во
СГМУ, 2002. 198 с.
4. Родионов И.В. Костные металлоимплантаты с
оксидными биосовместимыми покрытиями / Сб. трудов XV Междунар. научн.-практ. конф.
«Современные техника и технологии». Томск: Изд-во ТПУ, 2009. Т.1. С. 569-571.