асп. Листопад Д.А., д.т.н., проф. Червоный И.Ф.,
к.т.н., доц. Иващенко В.И., к.х.н., доц. Сорокина Л.В.
Запорожская государственная инженерная академия, Украина
Исследование взаимодействия легирующих элементов стали
12Х18Н10Т с кислородом
Аннотация.
Проведен термодинамический анализ реакций взаимодействия
основных компонентов стали (железа, хрома, марганца и никеля) с кислородом применительно
для магнийтермического способа получения титана.
Введение.
Технология получения
губчатого титана заключается в восстановлении четырёххлористого титана
расплавом магния в стальной герметичной реторте (реакторе). Во время проведения
процесса реактор испытывает высокие температурные нагрузки (до 1050°С [1]) и
агрессивное воздействие хлоридов титана и магния внутри, а также расплава
магния и, снаружи, окисление кислородом воздуха. Для повышения длительности
эксплуатации реторты в таких экстремальных условиях и обеспечения высоких
механических характеристик реторты изготавливают из высоколегированной
аустенитной стали 12Х18Н10Т. Никель содержащийся в стали реторты обеспечивает
приемлемую механическую и коррозионную стойкость, а также высокую
окалиностойкость [2]. Однако содержание в стали никеля негативно сказывается на
качестве получаемой губки, которое строго лимитируются ГОСТом 17746-96. Попытки
применения других сталей (даже двухслойных реторт) не увенчались успехом и были
связаны с большими технологическими трудностями [1].
Обычно реактор
эксплуатируют 36-38 циклов [2]. Одной из причин вывода реактора из эксплуатации
является недопустимая величина утонения реторты, которое происходит одновременно
с двух сторон – изнутри под агрессивным воздействием реакционной массы
(хлоридов титана, магния и расплавленного магния), и снаружи – кислородом воздуха.
По технологии во время
процесса необходимо поддерживать определённую температуру стенки реактора, для
этого в печи в которой находится реактор, расположены нихромовые нагреватели и
воздушные охладители. Воздействие воздуха на раскалённый металл реактора
вызывает образование окалины, а значит и утоньшение стенки реактора. После каждого
процесса реакторы охлаждают воздухом и водой – что также вызывает интенсивное
окалинообразование и утоньшение стенок реактора.
Задача исследования являлось выполнение
термодинамического анализа взаимодействия металлов (Fe, Cr, Ni, Mn) с кислородом. И установление основных
процессов приводящих к окалинообразованию.
Методика исследования. Для выяснения поведения легирующих
элементов в кислородной среде (основных компонентов стали Fe, Cr, Ni, Mn) проведены теоретические расчёты
термодинамической вероятности протекания процессов взаимодействия легирующих
элементов с кислородом. Причём, для первого приближения предположили, что
легирующие элементы представляю собой чистые металлы, а не сплавы друг с
другом. Также в расчётах не учитывалось образование на поверхности металла
защитных окисных плёночных образований сдерживающих процесс окисления металла.
Т.о. в расчётах не были учтены кинетическая составляющая протекающих процессов.
Для графического представления
путей возможного протекания процессов были составлены схемы – в которых между
исходными металлами и продуктами окисления изображены стрелки с кислородом.
Причём реагенты и/или продукты реакции приведены с коэффициентами учитываемыми
в расчётах. Если предположительных путей перехода между веществами несколько,
то на схеме эти пути изображены друг над другом и их следует понимать как
отдельные реакции. Согласно принятым в металлургической термодинамике правилам
[4] расчёты велись на 1 моль-атом металла, и, если в результате реакции образовывались
вещества с кратным количеством (Fe2O3, Cr2O3, и т.д.) атомов – то коэффициенты уравнения делились на это
кратное число в результате чего получались уравнения с дробными коэффициентами
(⅓, ⅔ и т.д.). Для удобства восприятия графиков над стрелками в
схемах реакций в скобках указаны латинские буквы, а на графиках каждая линия
подписана соответствующей ей буквой. Для расчётов были использованы основные
термодинамические характеристики [3, 4]. Расчёты выполнялись по стандартной
методике [3]. Предельной температурой до которой проводились расчёты изобарного
потенциала была выбрана 1600 К при которой происходит испарение TiCl3 и TiCl2, а также потому как до такой температуры реактор с
реакционной массы в ходе ведения процесса никогда не нагревают. В случае если один из реагентов
разлагался при температуре ниже 1600 К расчёт проводился до температуры
разложения реагента. Результаты расчётов реакций для некоторых металлов представлены в
виде графиков на рис. 1 - 4.
Железо. При н.у. возможно образование трёх оксидов (FeO, Fe3O4 и Fe2O3).
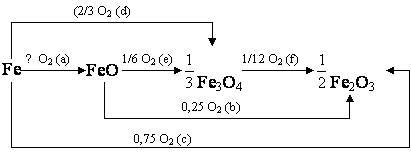
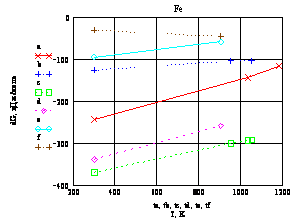
Рис. 1 – Температурная зависимость ΔGT возможного пути окисления
металлического железа и его оксидов под воздействием кислорода.
Из рисунка 1 видно, что
образование оксидов железа из металла и их доокисление до высших степеней
окисления термодинамически возможно на всём рассмотренном температурном
диапазоне.
Хром. При н.у. устойчивы три оксида (Cr2O3, CrO2 и CrO3), возможные реакции образования этих веществ
представлены на схеме:
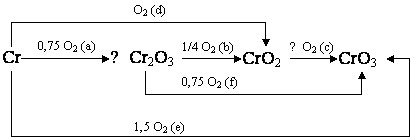
Из графика (рис. 2) видно,
что образование всех трёх оксидов хрома термодинамически возможно, однако, на
практике окисление хрома может быть затруднено плотной оксидной плёнкой на
поверхности металла, которая предотвратит образование оксидов. Реакции
окисления низших оксидов до более высоких степеней окисления термодинамически
невыгодный процесс.
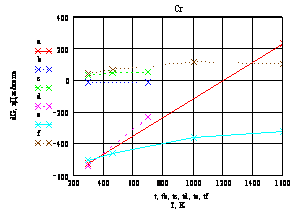
Рис. 2 – Температурная зависимость ΔGT возможного пути окисления
металлического хрома и его оксидов под воздействием кислорода.
Т.о. можно предположить,
что хром, как легирующая добавка препятствующая окалинообразованию,
малоэффективен. Но как один из компонентов стали который препятствует
взаимодействию стали реактора с хлоридами титана, хром более эффективен [1, 2].
Поэтому содержание хрома в стали реактора получения титановой губки должно быть
близким к теперешнему содержанию (18 %). Высокие концентрации хрома в стали
реактора негативно [1, 2] сказываются на механических свойствах реактора при
высоких температурах - возможно образование сквозных трещин и преждевременный
вывод из эксплуатации.
Марганец. Реакции взаимодействие марганца и его оксидов с кислородом представлены
на схеме:
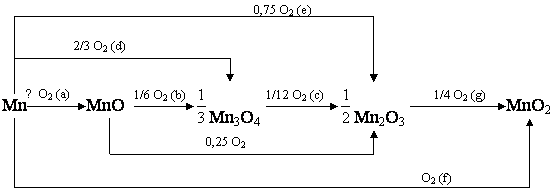
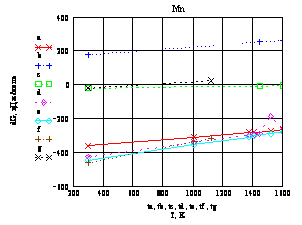
Рис. 3 – Температурные зависимости ΔGT возможных
путей окисления металлического марганца и его оксидов под воздействием кислорода.
Из графиков (рис. 3) видно,
что образование всех трёх оксидов марганца термодинамически выгодно на всём
рассмотренном диапазоне температур, но дальнейшее окисление оксидов марганца до
высших степеней окисления затруднено. Значения энергии Гиббса близки к нулю,
т.е. возможно химическое равновесие между Mn2O3 и MnO2, Mn3O4 и Mn2O3, а окисление MnO до Mn2O3 термодинамически не возможно на всём рассмотренном
температурном интервале.
Никель. У никеля возможно образование одного оксида по реакции:
Ni + ½ O2
→ NiO
Из рис. 4 видно, что
образование оксида термодинамически возможно на всём рассмотренном
температурном диапазоне. Однако, у никеля, как и у хрома, возможно образование
плотной оксидной плёнки которая может защитить металл от дальнейшего окисления.
Но содержание никеля в стали реактора негативно сказывается на качестве
титановой губки, поэтому содержание его в стали не желательно и необходимо
подобрать другие легирующие компоненты стали, которые обеспечат высокую
механическую и окалиностойкость.
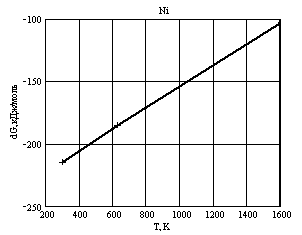
Рис. 4 – Температурная зависимость ΔGT возможного пути окисления
металлического никеля под воздействием кислорода.
Выводы. Исходя из полученных результатов, можно предположить, что высокую окалиностойкость
материала реактора можно достичь только при добавлении специальных легирующих
элементов. Металлы применяемы ныне (Fe, Cr, Ni, Mn) термодинамически не могут
обеспечить высокую окалиностойкость.
Литература
1.
Гармата В.А. и др. Металлургия титана. М.: Металлургия, 1967. - 643 с.
2.
Тарасов А.В. Металлургия титана. М.: ИКЦ Академкнига, 2003. - 328 с.:
3.
Термодинамические свойства неорганических веществ. Справочник. Под общ. ред. д.
т. н. А.П. Зефирова. М.: Атомиздат, 1965. - 456 с.
4.
Металлургическая термохимия. Кубашевский О., Олколл К.Б. Пер. с англ. М., «Металлургия»,
1982. 393 с.