д.х.н. 1Вигдорович
В.И., д.х.н. 2Цыганкова
Л.Е., д.х.н. 1Шель Н.В.,
асп. Морщинна И.В., к.х.н. 2Есина
М.Н., к.х.н. 2Урядников А.А.
1Всероссийский научно-исследовательский институт
использования техники и нефтепродуктов. Тамбов. Россия.
2Тамбовский государственный университет им. Г.Р. Державина.
Тамбов. Россия.
Закономерности совместной сорбции
концентратом глауконита катионов Са(II) и Mg(II) из хлоридных
растворов.
Целью настоящей работы
явилось исследование совместной сорбции катионов Са(II) и Mg(II) 95%-ным концентратом глауконита из хлоридных
растворов. Методика эксперимента изложена в [1, 2]. Добавим лишь, что изменение
общего числа моль-эквивалентов катионов Mg (II) и
Са (II) в результате их сорбционного извлечения из жидкой фазы при
совместном присутствии не позволяет оценить селективность процесса по этим
элементам. Для подобной оценки необходимы дополнительные экспериментальные
данные. С этой целью после завершения сорбции осаждали оставшиеся ионы Са (II) раствором
оксалата аммония и после фильтрации определяли оставшееся количество ммоль-экв Mg (II) прямым
комплексометрическим титрованием с Трилоном Б (индикатор эриохром черный Т).
Содержание катионов Са (II) оценивали из разности
количества (Mg (II) + Са (II))
и данных для Mg (II). Исходная величина рН
рабочих растворов в экспериментах составляла 5,8-5,9.
При сорбции из раствора (0.1 л),
содержащего по 5,0 ммоль-экв/л катионов Mg (II) и
Са (II), с массой адсорбента 3г их равновесные коэффициенты
извлечения в первые 5 минут близки между собой и составляют 27-29 % и далее
возрастают незначительно (рис.1а). Высокая скорость извлечения катионов
указывает что диффузия, по-видимому, не лимитирует процесс.
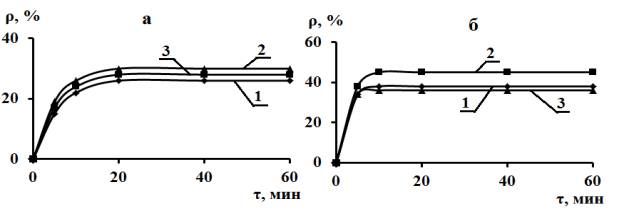
Рис.1
Зависимость глубины извлечения (ρ,%) катионов Mg(II)
и Са (II) 95%-ным концентратом глауконита при их совместном
присутствии в растворе с исходной концентрацией 5 ммоль-экв/л от массы
сорбента, m и продолжительности сорбции. Величина m,
г/0.1л раствора: а – 3; б – 6. Сорбция катионов: 1 – Mg(II),
2 – Са(II), 3 – суммарная величина.
При исходном соотношении количества
моль-эквивалентов Mg (II) и Са (II),
равном 1:1, их сорбированное отношение несколько меняется и близко к 1:1,1.
Следовательно, катионы Са (II) извлекаются сорбентом
в большей мере. Малую величину ρравн,i
можно объяснить сравнительно небольшой
сорбционной емкостью концентрата глауконита, эффективная величина
предельной удельной адсорбции Г∞,i которого по каждому
катиону близка к 0,047ммоль-экв/г, а Г∞,∑ составляет
0,094 ммоль-экв/г.
С предположением о сравнительно малой Г∞,i коррелирует и возрастание ρравн, i при увеличении вдвое массы сорбента (m) в
суспензии при неизменном ее объеме (рис 1б). Одновременно, в большей мере
дифференцируются и величины ρравн, i для Mg (II) и
Са (II) и их суммы. Эти значения составляют соответственно
38%, 45% и 36%. Разница между суммой
величин ρравн, Mg и ρравн, Ca и
экспериментальной величиной ρравн, ∑ объясняется
значительными различиями в величинах их масс моль-эквивалентов, отношение
которых равно 0,6. При удвоении m сорбента катионы Са(II)
вновь сорбируются более эффективно. При том же исходном соотношении в
растворе моль-эквивалентов катионов Mg (II) и
Са (II), равном 1:1, в условиях сорбционного равновесия отношение Mg(II)сорб:Са(II)сорб
изменяется до 1:1,36. Как и ранее, (рис 1) равновесие достигается за
время, меньшее 20 минут.
С ростом
удельной массы сорбента в суспензии вдвое
снижается эффективная величина предельной удельной адсорбции, составляющая для Mg(II),
Са(II) и их суммы соответственно 0,028; 0,037 и 0,065 ммоль-экв/г.
Следует полагать, что с ростом удельной массы сорбента m в суспензии снижается
удельная сорбционная поверхность Sуд за счет слипания его
частиц.
Представляло интерес выяснение влияния соотношения концентраций катионов на их
относительную сорбционную способность. С этой целью использовали среды,
содержащие 5 ммоль-экв/л Mg(II) и 2,5 ммоль-экв/лСа (II), а также модельные
растворы с обратным соотношением количества катионов. В том и в другом случаях
кинетические кривые сорбции имеют прежний вид, равновесие достигается за время
τр≤ 20 минут. При снижении исходной концентрации катионов
Са(II) вдвое и массе глауконита, равной 3г/0,1л суспензии, глубина извлечения Са (II)
и ρравн, i, ∑ возрастают, а для Mg(II)
остается практически на прежнем уровне (рис. 1а и 2а). При соотношении
концентрации катионов Mg(II) и
Са(II) в исходном растворе (моль-эквиваленты), равном 2,0:1,0 их
адсорбционное равновесие достигается при Mg (II)сорб:Са
(II)сорб близком к 1,4:1,0, т.е. вновь Са (II) сорбируется более эффективно. Величины Г∞,i
в этом случае составляют 0,047 (Mg), 0,037 (Са) и 0,084 (Mg+Са)
ммоль-экв/г. Для Г∞,Са, Г∞,Mg+
Са
они несколько понижены по сравнению с данным рис. 1а.
С ростом удельной массы сорбента вдвое
повышаются значения всех ρравн,i (рис 2б), но снижается Г∞,i и, составляют для Mg (II),
Са (II) и Mg (II) +
Са (II) соответственно, ммоль-экв/г: 0,040; 0,026 и 0,066. Вновь
при уменьшении исходной концентрации Са (II) вдвое, когда СMg
(II) остается неизменной, эффективные величины Г∞,Mg,
Г∞,Са и Г∞,Mg+Са заметно снижаются. При
начальном соотношении в растворе (в ммоль-экв/л) концентраций Mg (II)
и Са (II), равном 2:1, величина Mg (II)сорб:Са
(II)сорб составляет 1,55:1, вновь подтверждая более
эффективную сорбцию Са(II) по сравнению с Mg (II).
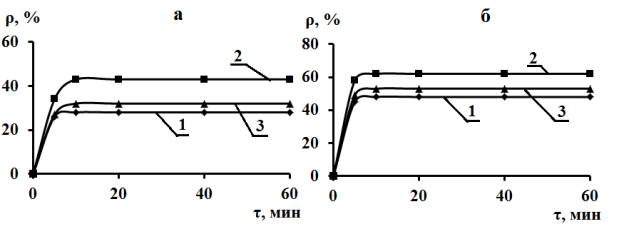
Рис.
2 Зависимость глубины извлечения катионов Mg(II)
и Са(II) 95%-ным концентратом глауконита при исходном совместном
присутствии в концентрациях соответственно 5,0 и 2,5 ммоль-экв/л от массы
сорбента и продолжительности сорбции. m, г: а – 3, б – 6.
Сорбированы: 1 – Mg(II), 2 – Ca(II),
3 – Mg(II) + Ca(II).
Литература.
1.Григорьева Е.А.
Сорбционные свойства глауконита Каринского месторождения. Дисс…канд. химич. Наук. Челябинск. 140с.
2. Вигдорович В.И.,
Цыганкова Л.Е., Морщинина И.В. Закономерности сорбции катионов Са(II) и Mg(II)
концентратом глауконита ГБМТО.// Сорбционные и хроматографические процессы.
2014. Т.14. №2. С. 65-74.
Исследование проведено в рамках выполнения задания Министерства
образования и науки РФ № 2014/285 (проект № 1501) на оборудовании ЦКП
«Нанохимия и экология» Тамбовского государственного университета имени Г.Р.
Державина.