Биологические науки/6. Микробиология
Каманин С. С., Арляпов В. А.
Тульский государственный университет,
Россия
Амперометрический биосенсор на основе печатных
электродов для анализа бродильных сред
В настоящее время активно разрабатываются
экспрессные методы анализа, характеризующиеся высокой доступностью и
достаточными уровнями чувствительности и избирательности. Представителями
подобных аналитических систем являются биосенсоры. Перспективным направлением
развития биосенсорных технологий является использование печатных электродов в
конструкции сенсоров. Печатные электроды уже используются в коммерческих
глюкометрах – биосенсорах для определения содержания глюкозы в крови, которые
сегодня фактически доминируют на рынке биосенсоров [1].
Подавляющее большинство глюкометров,
представленных на рынке, используют сменные тест-полоски, которые
изготавливаются методом трафаретной печати. Чаще всего в своей основе
тест-полоски имеют фермент глюкозоксидазу, которая катализирует реакцию
превращения глюкозы в глюконолактон с выделением пероксида водорода. Глюкометры
относятся к биосенсорам второго поколения, т. е., в них для переноса электронов
с фермента на электрод используется посредник – медиатор электронного
транспорта. Обычно для этой цели используются гексацианоферраты, как
эффективные и недорогие медиаторы [3]. C точки зрения применимости в биосенсорном анализе интересна берлинская
лазурь (KFe[Fe(CN)6]). Помимо обладания классическими для медиаторов свойств
(низкий редокс-потенциал, не зависящий от pH среды, химическая устойчивость в растворе), она является неорганическим
катализатором разложения пероксида водорода при потенциале 0 В [4]. Таким
образом, берлинская лазурь может использоваться как медиатор в оксидазных
биосенсорах, что подтверждается большим количеством публикаций, посвященных
разработке биосенсоров на основе печатных электродов, модифицированных
берлинской лазурью. Так, разработаны печатные электроды,
модифицированные глюкозоксидазой, включенной в состав графитовой пасты [5],
иммобилизованной в полиэтиленимин [6], в мембрану Nafion для кюветного [7] и проточно-инжекционного [8] режимов анализа. Включение
биоматериала в полимерные гели является одним из наиболее эффективных способов
иммобилизации. Он обеспечивает мягкие условия иммобилизации с применением
нетоксичных реагентов и хорошие диффузионные свойства получаемой матрицы.
Примером такой иммобилизации является включение в гель поперечно-сшитого
бычьего сывороточного альбумина (БСА) [9]. Получаемая после сшивания молекул
БСА глутаровым альдегидом матрица обеспечивает хорошую диффузию субстратов и
метаболитов и формирует благоприятное для иммобилизованных объектов белковое
окружение.
Таким образом, представляется актуальной
разработка модифицированных печатных электродов с ферментом глюкозоксидазой иммобилизованной
в гель поперечно-сшитого БСА для определения низких концентраций глюкозы.
В работе использовалась глюкозооксидаза с
удельной активностью 248 Е/мг, выделенная из дрожжей Aspergillus niger. На первом этапе работы была проведена оценка
стабильности разработанных модифицировавнных электродов. Долговременная
стабильность электродов составила 3 суток. За операционную стабильность
принимали относительное стандартное отклонение 15 последовательных измерений
одинаковой концентрации глюкозы. Относительное стандартное отклонение составило
3%.
Далее для разработанных электродов была
получена градуировочная зависимость ответа сенсора от концентрации глюкозы в
кювете (рисунок 1).
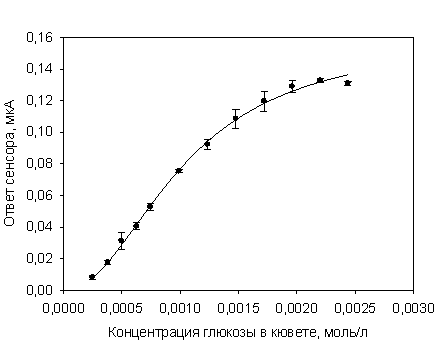
Рисунок 4.
Градуировочная зависимость отклика сенсора с ГО, иммобилизованной в БСА
Зависимость, приведенная на рисунке 1,
хорошо описывается уравнением Хилла. Основываясь на полученной зависимости,
рассчитали основные характеристики модифицированных электродов (таблица 1).
Таблица 1.
Основные параметры
разработанных модифицированных электродов
|
Параметр |
Значение |
|
Чувствительность,
мкА·М-1 |
90 |
|
Нижняя
граница определяемых концентраций, мМ |
0,03 |
|
Верхняя
граница определяемых концентраций (Км), мМ |
0,6 |
|
Долговременная
стабильность, сутки |
3 |
|
Операционная
стабильность (относительное стандартное отклонение), % |
3 |
|
Экспрессность,
мин |
1-2 |
Биосенсор на основе разработанных
электродов обладает узким диапазоном определяемых концентраций, но хорошей операционной
стабильностью, низкая долговременная стабильность позволяет использовать данные
электроды только как одноразовые.
С помощью разработанных модифицированных
печатных электродов проводили анализ
реальных образцов. В качестве реальных образцов были выбраны
апельсиновый сок и яблочный сок. В качестве референтного метода применяли
титриметрический метод анализа. Полученные результаты приведены в таблице 2.
Таблица 2.
Анализ реальных образцов
|
Образец |
Концентрация глюкозы, М |
|
|
Биосенсорный метод |
Титриметрический метод |
|
|
Апельсиновый сок |
0,32±0,01 |
0,332±0,002 |
|
Яблочный сок |
0,402±0,008 |
0,408±0,002 |
Значения, полученные являются близкими к
значениям, полученным референтным методом анализа.
Таким образом, в работе получены модифицированные
печатные электроды на основе медиатора берлинской лазури и фермента ГО,
иммобилизованной в гель поперечно-сшитого БСА. Определены основные
аналитические и метрологические характеристики полученных модифицированных
печатных электродов. Показано, что долговременная стабильность полученных
модифицированных печатных электродов – 3 суток, диапазон определяемых
концентраций составил 0,03-1,0 мМ, чувствительность равна 90 мкА·М-1.
С использованием разработанных электродов был проведен анализ реальных
образцов. Полученные значения являются близкими к значениям, полученным
референтным методом анализа.
БЛАГОДАРНОСТИ:
Работа выполнена при поддержке ФЦП
«Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы,
госконтракт № 16.740.11.0766.
Литература: