Химия и химические
технология/ 7. Неорганическая химия
Авина С.И., к.т.н. Гончаров И.И., Бондаренко Л.Н.
Национальный технический
университет˝ Харьковский политехнический институт˝ г. Харьков, Украина
Исследование процесса
выщелачивания примесей из платиносодержащих шламов азотного производства
Платиновые металлы в
природе находятся в виде самородной платины, реже в виде минералов сперрилита, куперита и браггита, а также как компонент медно-никелевых или сульфидно-медно-никелевых руд.
Основные
месторождения металлов платиновой группы находяться
в Южноафриканской Республике, Канаде,
России. Большую часть платиноидов добывают в ЮАР, но также надо отметить, что некоторые
ресурсы имеются в
России, Канаде, США, а также Колумбии. В Украине месторождения металлов платиновой группы отсутствуют, поэтому страна вынуждена
приобретать платиновые металлы за рубежом [1].
Таблица
– Мировое потребление металлов
платиновой группы
|
Область применения |
Pt |
Pd |
Rh |
Ir |
Ru |
|
Химическая промышленность |
4,5 |
3,4 |
2,8 |
48,0 |
37,0 |
|
Электротехническая промышленность |
4,3 |
26,5 |
1,8 |
- |
55,0 |
|
Автомобильная промышленность |
31,6 |
43,5 |
89,5 |
- |
- |
|
Ювелирная промышленность |
37,8 |
3,0 |
- |
- |
- |
|
Стекольная промышленность |
4,7 |
- |
3,7 |
- |
- |
|
Нефтеперерабатывающая
промышленность |
2,5 |
- |
- |
- |
- |
|
Закупки инвесторами |
7,2 |
- |
- |
- |
- |
|
Прочее |
7,4 |
23,6 |
2,2 |
52,0 |
8,0 |
Одними из важнейших
областей применения платины являются автомобильная,
химическая и нефтеперерабатывающая промышленность. В качестве катализатора
различных реакций используется около половины всей
потребляемой платины. Одним
из важнейших каталитических процессов
является окисление аммиака до оксида азота (II) с
целью получения азотной кислоты (по оценочным данным ежегодно идет до 10
% добываемой в мире платины).
Одной
из проблем производства азотной кислоты являются значительные потери платиноидного катализатора в контактном аппарате синтеза
аммиака [2]. Учитывая то, что металлы платиновой группы очень дорогие и
остродефицитные, а Украина, как было сказано ранее, не располагает собственными
месторождениями платиноидов, исследования направленные на уменьшение потерь и
вложений металлов платиновой группы, а также извлечение платиноидов из
различных платиносодержащих шламов являются актуальными и своевременными.
В
процессе эксплуатации установок производства азотной кислоты под давлением
0,716 МПа было установлено, что внутренняя поверхность аппаратов покрыта очень
мелким налетом, который содержит в себе металлы платиновой группы. Для
исследования выбран шлам, который был извлечен из котла-утилизатора нитрозных
газов производства азотной кислоты.
Процесс
извлечения металлов платиновой группы из шлама можно условно разделить на две
стадии. На первой происходит выщелачивание растворимых примесей из шлама, а на
второй растворение платиноидов в смеси соляной и азотной кислот (растворение в
царской водке).
На
рисунке приведены данные по
выщелачиванию растворимых примесей из шлама азотного производства с помощью
соляной кислоты.
Анализируя
графические данные можно, сделать вывод, что процесс выщелачивания примесей из
шлама азотного производства практически заканчивается к 30 минуте. При этом
достигается наибольшее значение степени выщелачивания, которая равняется 27%
для 10 % раствора соляной кислоты и 36 %
для концентрированной соляной кислоты соответственно.
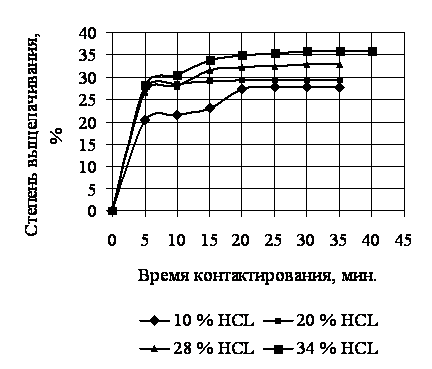
Рис. – Зависимость степени
выщелачивания шлама азотнокислотного производства от
времени взаимодействия с соляной кислотой.
Таким
образом, исследование показало, что для соляной кислоты с концентрацией 28 %
наблюдается меньшая степень выщелачивания по сравнению с концентрированной
соляной кислотой, но использование 28 % кислоты в этом процессе представляется
более целесообразным с точки зрения экономии реагента. При этом оптимальное время выщелачивания примесей
из шлама азотного производства сохраняется.
Литература:
1.
Авина С.И, Гончаров И.И., Лысикова И.В. Анализ потребления платины за
последние три десятилетия // Вестник НТУ ХПИ. – Харьков. –
2006. – № 12. – с. 94 – 97.
2.
Караваев
М.М., Засорин А.П., Клещев
Н.Ф. Каталитическое окисление аммиака. – М. 1983. – 286с.