Химия и
химические технологии/7. Неорганическая химия
К.х.н. Михайлов В.И.*,
д.х.н. Скворцов В.Г.*, к.х.н. Ершов М.А.**,
Грибков А.М.*, Иванов С.А.**
* Чувашский государственный педагогический
университет им. И.Я. Яковлева
(ЧГПУ им. И.Я. Яковлева), г. Чебоксары, Российская Федерация
**Чувашская государственная сельскохозяйственная
академия (ЧГСХА),
г. Чебоксары, Российская Федерация
ИНГИБИРОВАНИЕ
КОРРОЗИИ СТАЛИ В НЕЙТРАЛЬНЫХ СРЕДАХ ПРОПАНОЛАМИНОМ И ЕГО БОРАТОМ
Методами изотермической
растворимости, денси-, рефракто- и рН-метрии было установлено, что ортоборат
водорода с пропаноламином (ПА) при 25 °С образует в водной среде
триборатпропаноламмоний (ТБПА) состава [НО(СН2)3NН3].[В3О3(ОН)4].2Н20[1].
В развитие [2] проведено
сравнительное изучение влияния пропаноламина и его бората на
коррозионно-электрохимическое и коррозионно-усталостное поведение углеродистой
стали в нейтральных средах методами гравиметрии, снятия потенциодинамических
поляризационных кривых и циклического нагружения.
В
качестве материала для исследования использовали сталь 10 (Ст. 10). По результатам гравиметрических
исследований рассчитывали значения ингибиторного эффекта γ и степени защиты Ζ. Электрохимические
измерения выполняли на потенциостате П-5848 в потенциодинамическом режиме
поляризации. Электрод сравнения - хлоридсеребряный (х.с.э.). Защитное действие
ингибиторных добавок оценивали величиной плотности анодного тока (ia, мкА/см2 ) в
области пассивного состояния при φ = +0,2
В. Циклические напряжения
в металле создавали на установке для коррозионно-усталостных испытаний.
Основные характеристики циклической прочности
металла
определяли по значениям
коэффициента запаса циклической прочности σ 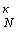 на
на
базе N = 4.106 циклов и
циклической долговечности N при σ =
±325,0 МПа. Коррозионно-активной
средой служили дистиллированная вода и раствор, содержащий 30 мг/л NaCl + 70
мг/л Na2SO4.
Концентрация добавок составляла 2.10-2 моль/л. Форма и размеры образцов,
характер их подготовки, а также методика коррозионных, электрохимических и
коррозионно-усталостных испытаний описаны в [3, 4]. Все измерения проводили при
естественной аэрации и температуре 20 ± 0.2 °С.
Таблица. Влияние ПА и ТБПА на коррозионно-электрохимическое поведение и
основные характеристики циклической прочности Ст. 10 в нейтральных средах
|
Коррозионная
среда
|
γ
|
Ζ,%
|
ia ,
мкА/см2
|
σ 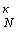 , МПа , МПа
|
N, циклы
|
|
Воздух
|
327.0
|
5.0.106→
|
|
Н2Одист.
(фон)
|
200.0
|
1.5.105
|
|
В присутствии:
|
|
|
|
ПА
|
16.34
|
93.88
|
2.7
|
288.0
|
1.0.106
|
|
ТБПА
|
25.73
|
96.11
|
2.4
|
296.5
|
1.4.106
|
|
30 мг/л NaCl + 70 мг/л Na2S04
(фон)
|
186.0
|
1.4.105
|
|
В присутствии:
|
|
|
|
ПА
|
11.96
|
91.64
|
3.1
|
234.5
|
3.0.105
|
|
ТБПА
|
13.45
|
92.56
|
2.6
|
247.5
|
3.7.105
|
|
|
|
|
|
|
|
Из данных таблицы следует,
что в фоновых электролитах Ст. 10 интенсивно корродирует. Хлорид- и
сульфат-ионы заметно ускоряют коррозионный процесс. Введение ПА и ТБПА в
коррозионные среды существенно снижает скорость ионизации металла, уменьшает
плотность анодного тока в области пассивного состояния и повышает основные характеристики циклической прочности металла. Триборатпропаноламмоний
обладает большей ингибирующей
способностью, чем пропаноламин.
Результаты гравиметрических
исследований, электрохимических измерений и коррозионно-усталостных испытаний
хорошо согласуются друг с другом и ранее полученными данными [2].
Антикоррозионные
свойства пропаноламина, по-видимому, связаны с образованием
аминоборатного комплекса за счет неподеленных пар электронов
атомов азота и
вакантных d-орбиталей ионов железа [5]. Возникновение
хелатных циклов возможно также через группу ОН [6]. По [5, 7]
оксобораты образуют на металле труднорастворимые соединения. Увеличение
ингибирующей способности ТБПА, вероятно, обусловлено формированием на
поверхности металла более лучшей защитной феррогидроксоаминоборатной
пленки, образуемой посредством донорно-акцепторной связи через n-дублеты атома азота, ОН-групп и хемосорбции борат-ионов [8].
Таким
образом, пропаноламин и триборатпропаноламмоний являются достаточно эффективными
ингибиторами и при оптимальных концентрациях могут быть использованы для защиты
черных металлов и их сплавов.
Литература:
1.
Скворцов В.Г., Цеханский Р.С., Сукова Л.М. и др. // Журн. неорган. химии. - 1986. - Т. 31. - № 8. - С. 2140-2142.
2. Михайлов
В.И., Скворцов В.Г., Ершов М.А. и др. // Материалы V Международной научно-практической
конференции «Наука и образование -2007». - Т. 10 - Днепропетровск: Наука и
образование, 2007. - С. 28-31.
3. Скворцов
В.Г., Яхваров Г.И., Михайлов В.И. и др. // Защита металлов. - 1987. - Т. 23. - №1. - С. 161.
4.
Фрейман Л.И., Макаров В.А., Брыксин И.Е. Потенциостатические
методы в коррозионных исследованиях и электрохимической защите. - Л.:
Химия, 1972. - 214 с.
5. Розенфельд И.Л. Ингибиторы коррозии. - М.: Химия, 1977. - 352 с.
6. Розенфельд
И.Л., Вердиев С.Ч., Кязимов A.M. и др. // Защита металлов. - 1982. - Т. 18. - № 6. - С. 866.
7.
Розенфельд И.Л., Фролова Л.В., Тавадзе Н.Н. // Защита металлов. - 1980. - Т. 16. - №2. - С. 133.
8.
Михайлов В.И., Яхваров Г.И., Скворцов В.Г. и др. // Защита металлов. - 1985. - Т. 21. - №5. - С. 828.
![]() на
на