Мартюшенко В.А., Панасюк А.Г.
Украинский государственный
химико–технологический университет
г. Днепропетровск, Украина
Синтез N–(полинитроарил)тиофенсульфамидов
Тиофен является ценным химическим сырьем, содержащимся в бензольной фракции продуктов коксования угля. Поскольку тиофен является токсичным веществом, а также каталитическим ядом при промышленном использовании бензола [1], от него освобождаются при сернокислотной очистке. При этом тиофен переходит в токсичные кислые смолы, представляющие собой вредные отходы производства. Поэтому тиофен целесообразно выделять методом экстрактивной ректификации[2]. Кроме того, возможен синтез тиофена из алканов, или ацетилена, и серы. Поэтому производство тиофена в СНГ имеет широкую сырьевую базу.
Некоторые функциональные производные тиофена, в частности, N-замещенные тиофенсульфамиды
проявляют фунгицидную и гербицидную активность[3], среди них найдены
радиопротекторы[4], лекарственные препараты[5-8], красители[9], полупродукты
при производстве полимеров[10] и т д. Интерес к разработке методов синтеза
перспективных биологически активных производных тиофена сохраняется в настоящее
время, о чем свидетельствуют работы[11-12].
В настоящей работе нами были синтезированы некоторые N-(полинитроарил)тиофенсульфамиды и
исследованы их свойства как лигандов в реакциях комплексообразования.
В работе[13] n-амино-N-(2,4-динитрофенил)бензолсульфамид
получен сплавлением при 1400С натриевой соли сульфаниламида с
2,4-динитроанизолом. Недостатком способа является энергоемкость и сравнительная
опасность процесса. Аналогичный способ динитроарилирования предложен в [14].
Нами использовался метод полинитроарилирования, аналогичный описанному в [3],
который является более удобным и безопасным в технологическом отношении.
Исходный тиофен получали по описанному способу [15] из Р4S7 и сукцината натрия, или выделяли из
коксохимического сырья [16]. 2-хлор(бром) и 2,5-дихлор(дибром)тиофены получены
по известным методикам[17-20]. 2-йодтиофен получен йодированием тиофена в
присутствии окиси ртути [15]. Полученные галогентиофены перевели в
соответствующие замещенные тиенилсульфохлориды по общей схеме[21]:
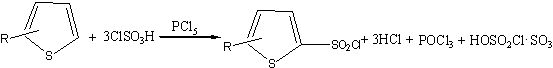
Продукты реакции были
выделены и затем действием избытка аммиака переведены в соответствующие
сульфамиды [22]. 2,4-тиофендисульфохлорид синтезировали по методу, аналогичному
предложенному в работе [23], и без дополнительной очистки превращен в
2,4-тиофендисульфамид.
2,4,6-тринитрохлорбензол синтезирован по оригинальной
методике (см схему):

2,4,6-тринитро-1,3-дихлорбензол
также синтезирован по аналогичной схеме
из более доступного 2,4,6-тринитрорезорцина с использованием хлорокиси фосфора:

1,3-дибром-4,6-динитробензол получен прямым нитрованием м-дибромбензола нитрующей смесью, содержащей 1-2% свободного SO3.
Полинитроарилиование тиофенсульфамидов проводили в водной среде в присутствии NaHCO3, при нагреве или кипячении реакционной массы. По окончании процесса получали водные растворы соответствующих натриевых солей (продукты реакций являются NH-кислотами), целевые соединения выделяли подкислением реакционной массы с последующим фильтрованием. Выделенные продукты очищали путем перекристаллизации из этанола.
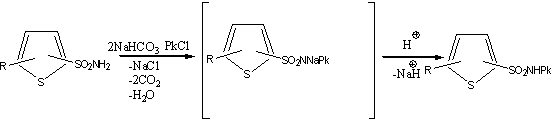
Iа-ж

II а-е

III

IV
Состав полученных соединений доказан методом элементного анализа (см табл).
Таблица
Состав и некоторые физико–химические свойства N–(полинитроарил) тиофенсульфамидов I, II, III, IV
|
Соединение |
Брутто-формула |
Найдено Вычислено, % |
Выход, % |
|||
|
Шифр |
R |
Гетероцик- лический фрагмент |
N |
S |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Іа |
Н |
2-тиенил |
C10H6N4O8S2 |
15,38 14,97 |
16,51 17,13 |
76 |
|
Іб |
5-Cl |
5-хлор-2-тиенил |
C10H5ClN4O8S2 |
14,20 13,71 |
15,34 15,69 |
75 |
|
Ів |
5-Br |
5-бром-2-тиенил |
C10H5 BrN4O8S2 |
12,10 12,36 |
14,65 14,15 |
74 |
|
Іг |
5-I |
5-йод-2-тиенил |
C10H5 IN4O8S2 |
11,58 11,20 |
12,40 12,82 |
88 |
|
Ід |
5-CH3 |
5-метил-2-тиенил |
C11H8N4O8S2 |
14,85 14,43 |
16,12 16,51 |
71 |
|
Іе |
2,5-Cl2 |
2,5-дихлор-3-тиенил |
C10H4Cl2N4O8S2 |
12,38 12,64 |
14,75 14,47 |
71 |
|
Іж |
2,5-Br2 |
2,5-дибром-3-тиенил |
C10H4Br2N4O8S2 |
10,91 10,53 |
11,66 12,05 |
77 |
|
ІІа |
H |
2-тиенил |
C14H9N5O10S4 |
13,54 13,08 |
23,71 23,95 |
67 |
|
IIб |
5-Cl |
5-хлор-2-тиенил |
C14H7Cl2N5O10S4 |
11,20 11,59 |
21,67 21,22 |
76 |
|
IIв |
5-Br |
5-бром-2-тиенил |
C14H7Br2N5O10S4 |
9,88 10,10 |
18,73 18,50 |
70 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ІІг |
2,5-Cl2 |
2,5-дихлор-3-тиенил |
C14H5Cl4N5O10S4 |
10,97 10,40 |
18,61 19,05 |
81 |
|
ІІд |
2,5-Br2 |
2,5-дибром-3-тиенил |
C14H5Br4N5O10S4 |
8,65 8,22 |
14,69 15,07 |
80 |
|
IIе |
5-I |
5-йод-2-тиенил |
C14H7I2N5O10S4 |
9,27 8,90 |
8,42 8,15 |
78 |
|
ІІІ |
H |
2-тиенил |
C14H10N4O8S4 |
11,08 11,42 |
25,81 26,15 |
67 |
|
ІV |
H |
2,4-тиенилиден |
C16H8N8O16S3 |
16,53 16,86 |
13,83 14,48 |
91 |
Строение полученных соединений подтверждено методами ИК- и ПМР- спектроскопии. В частности, на спектре Іе имеются сигналы ароматических протонов пикрильной группы в области 8.59-8.62 м.д. (синглет), сигнал протона тиофенового фрагмента в области 7.02 м.д.(синглет), сигнал протона NH-группы сульфамида в области 5.16 м.д. (шс).
Нами также получены хелаты Cu(II) и Co(II) на основе некоторых N-пикрилсульфамидов по схемам:
2HL+2NaOH+CuX2 =CuL2
+2NaX+ 2H2O;
2HL+2NaOH+CoX2
=CoL2 +2NaX+ 2H2O;
где HL= Іа-г, Х= AcO -, Cl-
,NO3-.
Синтез проводили в водных растворах, осадки хелатов
отфильтровывали, промывали водой и сушили до постоянной массы. Состав и
строение комплексов доказывали методами элементного анализа и ИК-спектроскопии.
Мы полагаем, что исходные сульфамиды являются S,N-хелатирующими лигандами, образующими
связь с центральным атомом за счет атома N сульфимидного фрагмента и атома S гетероцикла; в комплексах
реализуется координационный узел МN2S2( М=Cu, Co). Это согласуется с полученными данными по составу и
строению синтезированных хелатов.
Изучается возможность получения комплексных соединений Cu, Co в высших степенях окисления с
вышеупомянутыми лигандами.
Возможные
направления практического применения синтезированных соединений. Аналогичные по строению
вышеописанным соединениям, натриевые соли 2,5-дихлор-3-тиофенсульфонил-2′,4-динитроанилида,5-хлор-2-тиофенсульфонил-2′,4′-динитро-анилида,2-тиофенсульфонил-2′,4′-динитроанилида,5-метил-2-тиофенсульфонил-2′,4′-динитроанилида
являются эффективными ингибиторами коррозии углеродистых сталей в воде
обеспечивая практически полную защиту (степень защиты 90-98,9%) при t=20-90єC при малом содержании
ингибитора (0,05-0,6 г/л) [3].
Замещенные
2-тиофенсульфонил(полинитроанилиды) могут быть рекомендованы как эффективные
пестициды, они могут также проявлять фунгицидную и нематоцидную активность.
Следует отметить перспективность изучения в качестве пестицидов подобных
замещенных тиофенсульфамидов, поскольку даже на небольшом количестве испытанных
соединений обнаружена их физиологическая активность [24].
Наконец,
безусловный интерес представляет изучение биологической активности, в
частности, N-полинитроарил-5-йод-2-тиофенсульфамидов и их комплексов. Известно, что
натриевая соль 5-йод-2-тиофенсульфонил-2′,4′-динитроанилида
рекомендована в качестве препарата для лечения тиреотоксикоза [25], что
особенно актуально для жителей регионов СНГ, пострадавших от последствий аварии
на ЧАЭС, а также испытывающих воздействие техногенных источников радиоактивного
загрязнения.
Литература
1. Титушкин В.А.,
Фроловин Ю.В., Соколов В.З. и др./Кокс и химия.1979.№10.С.48-52.
2. Мирошниченко А.К.,
Дубровская Д.П., Зарецкий М.И. и др./ Кокс и химия.1979.№2.С.27-30.
3. Мартюшенко В.А. Синтез
и свойства N-замещенных тиофен (и арен) сульфониламидов.-Дисс…к.х.н.:02.00.03.
Днепропетровск, 1984.-169с.
4. Marino G./ Advances in Het. Chem. N.Y.-L: Acad.
Press.1971.V.13.P.235-314.
5. Boggiano B.G., Petrov V., Stephenson O.,etc./J.Pharm and
Pharmacol.1961.V.13. №9.P.567-574.
6. El-Kerdawy M.M., Selim H.A./J.Drug. Res.1972.V.4 №1-2.P.135-141.
7. Пат.США№3954741/
T.K.Schaaf, L.J.Czuba, H.J.E. Hess;опубл.1976.
8. Пат.№1468111
Великобритания/P.E.Cross,
R.P.Dickinson,опубл
1977.
9. Пат.№1404615
Франция/A.Simonnet,
L.Cabut, опубл.1966.
10. Пат.№968212
ФРГ/G.V.Gundel,
опубл.1960.
11. Розенцвейг И.Б.,
Айзина Ю.А., Чернышов К.А., Клыба Л.В. и др./ЖОХ.2007.Т.77№5.С.831-836.
12. Aizina Ju. A., Rozentsveig I.B., Ushakova I.V., Levkovskaya G.G., Mirskova A.N. / Arkivoc.2004.Pt.XI.P.25.
13. Bretschneider H., Klotzer W. / Monatsh.Chem.1956.Bd.87, №1.S.120-130.
14. Szczucki T., Okon K. / Roczn. chem.1960.T.34, №6.S.1577-1584.
15. СОП. Cб.2. / Под.
ред. Б.А. Казанского. М. ИЛ.1949.
16. А.С. №398548
СССР. Способ разделения тиофеновой фракции сырого бензола / Ю.А. Кованько, В.А.
Иващенко, А.С. Ковалевский и др. Опубл.1973.
17. Blicke F.F., Burckhalter J.H. / JACS.1942.V64, №3.P.477-480.
18. Mozingo R., Harris S.A., Wolf D.E. etc / JACS.1945.V.67, №12.P.2092-2095.
19. Campaigne E., Le Suer W.M. / JACS.1948.V.70, №1.P.415-416.
20. Buzas A., Teste J. / Bull.Soc.Chim.France.1960.№5.P.793-803.
21. Пат.
№1088509 ФРГ.
Verfahren zur Herstellung von Thiophen-monosulfochloriden / W. Siedel, K.
Sturm. Опубл.
1962.
22. Chrzaszczewska A., Szalecki W. / Soc. scient.lodz.acta chim.1965.V.10.P.65-69.
23. Пат.
№1088508 ФРГ.Verfahren
zur Herstellung von Thiophen-disulfochloriden / W. Siedel, K. Sturm, Опубл.1962.
24. Мартюшенко В.А.,
Панасюк А.Г., Шестозуб А.Б., Сухонос А.А. / Мат.VI Всеукр. научно-практ. конф. „Екологія
та інженерія. Стан, наслідки, шляхи створення екологічно чистих технологій”.
Днепродзержинск, 28-29.11.06.С.39-42.
25. Мартюшенко В.А. Бондарь В.К. и др. / Мат.VI Всеукр. научно-практ. конф. „Екологія та
інженерія. Стан, наслідки, шляхи створення екологічно чистих технологій”.
Днепродзержинск, 28-29.11.06.C.42-47.