Биологические
науки/9.Биохимия и биофизика
D. Sc. (Biol.) Eroshenko F.V., C.Sc. (Biol) Dudenko N.V.
Stavropol Research Institute of Agriculture, Russian
Federation
EVALUATION
OF PHOTOSYNTHETIC PRODUCTIVITY
OF
PLANTS
Summary. The
work provides definitions and presents the methodology for obtaining and
calculation of the main characteristics of the photosynthetic productivity of
plants (the size of the assimilation surface, the amount of photosynthetic
pigments, the ratio chlorophylls a/b, ratio chlorophyll light-harvesting
complex to chlorophyll of reaction centers, leaf area index, surface
photosynthetic potential, chlorophyll photosynthetic potential, photosynthetic
active potential, the rate of quenching of delayed fluorescence, the
coefficient of energy efficiency of photosynthesis, net productivity of
photosynthesis).
Keywords: photosynthetic
productivity, assimilation surface area, chlorophyll, delayed fluorescence,
photosynthetic potential, net productivity of photosynthesis.
Д.б.н. Ф.В.Ерошенко, к.б.н. Н.В.Дуденко
ОЦЕНКА ФОТОСИНТЕТИЧЕСКОЙ ПРОДУКТИВНОСТИ
РАСТЕНИЙ
Показатели фотосинтетической продуктивности растений, как правило,
расчетные величины. Вычисляют их с использованием двух основных характеристик –
площадь ассимиляционной поверхности и количество хлорофилла. Далее мы
представим основные существующие методы определения размеров ассимиляционного
аппарата и фотосинтетических показателей, а так же некоторые их модификации,
применявшиеся в наших исследованиях и которые позволили, с одной стороны
несколько упростить способы определения, а с другой – повысить их
объективность, без уменьшения достоверности полученных результатов.
1. Определение площади ассимиляционной
поверхности
Для определения площади фотосинтезирующей поверхности существует
несколько способов, но все они относятся к, так называемому, весовому методу.
Площадь листьев.
Метод отпечатков. Этот метод имеет несколько вариаций
исполнения. Так лист растения накладывают на однородную бумагу и обводят контур
карандашом. Отпечаток можно получить и при помощи светочувствительной бумаги
(лист кладут на светочувствительную бумагу, накрывают стеклянной пластиной и
помещают под источник света на 3-5 мин). Отпечаток так же можно получить с помощью
обыкновенного ксерокса или используя компьютер и сканер. Такой способ нами был
неоднократно проверен в исследованиях. Он с высокой точностью значительно
упрощает процесс определения площади ассимиляционной поверхности. Одним из
преимуществ этого метода является то, что отпечатки листа можно хранить долгое
время, а в случае, когда получены сканированные данные ‒ еще и в
электронном виде.
По отпечатку листа легко определить его площадь. Для этого вырезают по
контуру листовой пластинки бумагу и взвешивают на торзиоиных или аналитических
весах. Из такой же бумаги вырезают квадрат определенной площади, например 100
см2 (10х10 см), и также определяют его массу.
Площадь исследуемого листа находят по формуле:
S = a·C/b, где
а ‒ масса отпечатка листа, мг;
b ‒ масса квадрата бумаги, мг;
С ‒ площадь квадрата бумаги, см2.
Метод высечек. Для определения площади листьев отбирают
листья и определяют их массу. Затем с помощью сверла из каждого листа выбивают
несколько высечек, объединяют вместе и устанавливают их массу. Диаметр сверла
выбирают в зависимости от размеров листовой пластинки. Площадь листьев
определяют по формуле:
S = a·c/M, где
а ‒ общая масса сырых листьев, г;
M ‒
общая масса сырых высечек, г;
с ‒ общая площадь высечек, см2.
Использование автоматического
анализатора площади –
наиболее простой способ определения ассимиляционной поверхности листьев
(например, ААМ-7 производство Япония). Берут листья определенной навески и при
помощи прибор определяют их площадь.
Площадь стеблей. Аналогично как в случае с листьями
определяют площадь контура стебля известной навески (либо методом отпечатков,
либо с использованием автоматического анализатора площади). Далее по формуле
рассчитывают площадь стебля. Формула основана на том, что площадь контура
стебля равна a·h, где a – основание (диаметр стебля), h – его высота. Если учесть, что площадь
цилиндра равняется 2·π·r·h, то легко вывести формулу площади стебля, используя величину площади
контура стебля:
S=π·Sk, где
Sk – площадь контура.
Далее весовым методом определяют площадь стеблей.
Поверхность колоса определяют по формуле В.А.Кумакова:
Sколоса
= 3,8·А·В, где
А – длина колоса;
В – ширина колоса, определяемая по расстоянию между кончиками
противостоящих колосков в средней части лицевой стороны колоса.
2. Определение количества фотосинтетических пигментов
Для извлечения пигментов из органов растений применяют полярные
растворители (этиловый спирт, ацетон). При классическом методе экстракции
пигментов [1] берут навеску растительной пробы (0,1-0,15г), помещают в фарфоровую
ступку, добавляют немного диоксида кальция, промытого кварцевого песка и
растирают с 2-3 мл 85%-го раствора ацетона. К растертой массе добавляют 4-5 мл
ацетона и снова растирают (в течение нескольких минут). После отстаивания
раствора экстракт сливают в воронку со стеклянным фильтром № 2 и отсасывают
насосом. Перед перенесением вытяжки воронку вставляют при помощи каучуковой
пробки в колбу Бунзена (или градуированную вакуумную пробирку), соединенную с
насосом. Экстракцию небольшими порциями чистого растворителя повторяют до тех
пор, пока пигменты не будут извлечены полностью. Затем фильтрат переливают
через сухую стеклянную воронку в мерную колбочку на 25 мл. Колбу Бунзена дважды
ополаскивают небольшой порцией ацетона, каждый раз сливая жидкость в мерную
колбочку. Далее содержимое колбочки доводят растворителем до метки, закрывают
каучуковой пробкой, тщательно взбалтывают и используют для определения
концентрации пигментов. Определяют оптическую плотность раствора на
спектрофотометре при двух длинах волн: 665 и 649 нм. Концентрацию хлорофиллов а
и b
(С) для этилового спирта рассчитывают по уравнениям Винтерманса и Де Мотса
(Wintermans, De Mots):
Сa = 13,70·D665 – 5,76·D649,(мг/л);
Сb
= 25,80·D649
– 7,60·D665,
(мг/л).
Концентрацию каротиноидов в суммарной вытяжке пигментов вычисляют по
уравнению Веттштейна (Wettstein):
Сk
= 4,7·D440
– 0,27·С(a+b), (мг/л).
Далее определяют содержание пигментов в 1 г навески:
A=(C·V·100)/P
С – концентрация пигмента в мг/л;
D – значения оптических плотностей в
максимумах поглощения хлорофилла a и b в красной области спектра;
А – содержание пигментов в мг/г сухого
веса;
V – концентрация пигментов в мг/л;
Р – навеска растительного образца.
Определение хлорофилла можно проводить менее трудоемким способом [2].
Он заключается в том, что измельченную навеску определенного органа растения
помещают в пробирку и заливают 96% этиловым спиртом. Пробирку плотно закрывают
каучуковой пробкой и помещают в темное место на 24-48 часов для экстракции
пигментов. Далее с помощью спектрофотометра определяют оптическую плотность
полученной вытяжки и по соответствующим формулам (Винтерманса и Де Мотса, а так
же Веттштейна) рассчитывают концентрацию пигментов.
В своих исследованиях мы определяли содержание хлорофилла в органах
растений озимой пшеницы с использованием способа, который заключался в
следующем. Разобранные по органа растения помещали в сушильный шкаф разогретый
до +110°С на 15 минут для фиксации, затем образцы
сушили в темноте при температуре +60°С до полного высыхания. Далее их
измельчали в лабораторной мельнице до получения однородной массы. Из этого
смешанного образца в 3-х кратной лабораторной повторности брали навески (20-50
г в зависимости от органа и фазы развития растений, при большем содержании хлорофилла
– навеска меньше), которые помещали в пробирки, заливали их 10 мл 96% этилового
спирта, плотно закрывали пробками и помещали в термостат, где в течение 24
часов при температуре +42°С без доступа света проходила экстракция
пигментов. Затем пробирки охлаждали в темноте до комнатной температуры и на
спектрофотометре определяли оптическую плотность вытяжек при соответствующих
длинах волн. Далее по формулам рассчитывали концентрацию хлорофиллов.
Количество хлорофилла одних и тех же проб, полученные с использованием этого
способ и с помощью метода, описанного Г.В.Наполовой и В.Т.Лобковым идентичны
(разница не превышает ошибки опыта). Преимущество метода определения хлорофилла
в сухих образцах заключается в том, что анализ производится в усредненной пробе
и, следовательно, исключается неравномерность распределения пигментов по органу
растения, а так же появляется возможность проводить лабораторные исследования
не сразу, а по истечению некоторого времени после взятия растительных проб.
3. Показатели фотосинтетической продуктивности
Листовой индекс ‒ отношение общей площади листьев
растений к площади посева (м2/м2).
Площадь ассимиляционной
поверхности – площадь
всех фотосинтезирующих органов растений. Этот показатель может относиться как к
одному растению или побегу (м2/растение, м2/побег), так и
к посеву в целом (м2/м2).
Содержание хлорофилла – количество хлорофилла a и (или) b в растении или посеве. Оно бывает
относительным и абсолютным (валовым). Относительное содержание хлорофилла
бывает двух видов – количество зеленых пигментов в единице биомассы сырой или
сухой (обычно мг/г) и единице площади ассимиляционной поверхности (обычно мг/дм2).
Абсолютное содержание хлорофилла – количество зеленых пигментов в органе
растений (мг/орган), в побеге или растении (г/побег или г/растение), на единице
площади посева или ценоза (г/м2 или ц/га).
Отношение хлорофиллов a/b – показатель, характеризующий, в
определенной степени, структурную организацию фотосинтетического аппарата. Так
как весь хлорофилл b находится в светособирающем комплексе (ССК), то чем меньше значение a/b, тем больше размеры ССК у растения (лучше
условия светосбора).
Отношение хлорофилла
светособирающего комплекса к хлорофиллу реакционных центров (ХлССК/ХлРЦ) – величина, показывающая, какое
количество хлорофилла светособирающего комплекса обслуживает хлорофилл
реакционных центров и характеризует условия светосбора при фотосинтезе. Так же
как и a/b позволяет косвенно оценить структурную
организацию фотосинтетического аппарата. Если учесть, что весь хлорофилл b находится в светособирающем комплексе, а
соотношение a/b в ССК составляет величину порядка 1,2, то
можно легко вычислить этот показатель:
ХлССК/ХлРЦ=(2,2·Хлb)/(Хлa–1.2·Хлb)
Фотосинтетический потенциал
(ФСП) – показатель,
характеризующий размеры фотосинтетического аппарата посева (растения или
побега) и время его функционирования. В зависимости от сортовых и
технологических особенностей, а так же от условий окружающей среды, динамика
площади ассимиляционной поверхности и количества хлорофилла у растений в
онтогенезе может быть различна. В связи с этим и возникла необходимость
использовать этот показатель для оценки фотосинтетической продуктивности. Когда
в расчете используют площадь ассимиляционной поверхности (посева, побега или
растения) получают поверхностный
фотопотенциал (ПФСП), а когда
количество хлорофилла ‒ хлорофилловый
(ХФСП). С математической точки зрения фотопотенциала – площадь фигуры
ограниченной снизу осью абсцисс, а сверху функцией изменений размеров
фотосинтетического аппарата (площадь ассимиляционной поверхности или количество
хлорофилла) за период вегетации. Или:
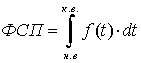 , где
, где
ФСП – фотосинтетический потенциал;
н.в. и к.в. – начало вегетации и конец
вегетации;
f(t) – функция, описывающая динамику размеров фотосинтетического аппарата
в течение вегетации (площадь ассимиляционной поверхности или количество
хлорофилла).
Если весь вегетационный период разбить на некоторые временные участки,
ограничивающиеся датами отборов, то вся фигура под функцией изменений размеров
ассимиляционного аппарата в приближенном виде будет представлена в виде
некоторого количества трапеций, где основание – период между отборами, а высоты
– размер фотосинтетического аппарата (площадь ассимиляционной поверхности или
количество хлорофилла) в начале и в конце рассматриваемого периода. Если
использовать формулу расчета площади трапеции (средняя величина высот,
умноженная на основание) получаем величину фотосинтетических потенциалов:
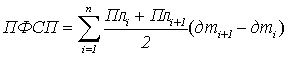
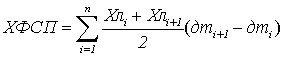 , где
, где
ПФСП – поверхностный
фотосинтетический потенциал;
ХФСП – хлорофилловый
фотосинтетический потенциал;
Пл – площадь
ассимиляционной поверхности посева;
Хл – количество
хлорофилла единицы посева;
дтi+1 ‒ дтi – количество дней i-го периода;
n – количество
периодов (количество отборов).
Фотосинтетические потенциалы, как правило, рассчитываются либо за
весь, либо за определенный период роста и развития растений. ПФСП и ХФСП достаточно
тесно коррелируют с урожайностью, как с общей, так и с хозяйственно ценной её
частью.
Рассмотренные показатели, хотя и точно характеризуют величину
фотосинтетического аппарата, а так же время его функционирования, но дают
представление лишь о возможностях посева формировать тот или иной урожай, так
как они довольно статичны и очень медленно реагируют на изменения окружающей
среды. Кроме того, активность процессов фотосинтеза зависит как от
генетических, так и от онтогенетических особенностей растений. Немаловажную
роль в этом играет структурная организация фотосинтетического аппарата. Поэтому
наряду с традиционными фотосинтетическими показателями используют и
характеристики активности процессов ассимиляции, такие как интенсивность
фотосинтеза, активность ферментов карбоксилирования и т.д. Для этих целей так
же подходят показатели, связанные с первичными процессами фотосинтеза, которые
наиболее отзывчивы на меняющиеся условия окружающей среды. Скорости их реакций
зависят от пространственной и структурной организации ассимиляционного
аппарата, поэтому даже незначительные воздействия на пигмент-белковые комплексы
отражаются на транспорте электронов − основы световых стадий фотосинтеза.
О состоянии и активности первичных процессов фотосинтеза можно судить по характеристикам
индукционной кривой замедленной флуоресценции (ЗФ) органов растений.
После предварительной темновой адаптации при включении света
наблюдается резкое увеличение свечения (J1) и после
незначительного спада оно возрастает вновь до максимального значения (J2).
Далее наступает медленная фаза тушения до стационарного уровня (J0).
Считается, что J1 и J2 связаны с величиной
протонного и электрохимического потенциала на тилакоидной мембране, а J0
– с той частью поглощенной светособирающим комплексом солнечной энергией,
которая не участвует в процессах фотосинтеза.
Скорость тушения замедленной
флуоресценции (СТЗФ) –
скорость, с которой интенсивность свечения снижается от максимального значения
до стационарного уровня. Она характеризует активность использования темновыми
реакциями продуктов первичных процессов фотосинтеза. СТЗФ рассчитывается как (J2 ‒ J0)/t0, где t0 – время, за которое свечение выходит на
стационарный уровень.
Коэффициент
энергетической эффективности фотосинтеза (Кээф) – показатель,
отражающий соотношение световой энергии попавшей в первичные реакции
фотосинтеза и эффективно ими использованной. Эта характеристика, в некотором
приближении является скоростью тушения ЗФ. Её преимущество заключается в том,
что это безразмерный коэффициент, в отличие от СТЗФ, у которой размерность
‒ отн.ед./сек.
Рассмотренные характеристики динамики
замедленной флуоресценции коррелируют с интенсивностью фотосинтеза, со
скоростью синтеза АТФ, а так же с другими восстановительными реакциями. Так нами
была установлена тесная взаимосвязь скорости тушения замедленной флуоресценции
с активностью ключевого фермента метаболизма азота ‒ нитратредуктазы.
Поэтому для оценки эффективности фотосинтетической
продуктивности посевов нами был предложен новый показатель – Активный фотосинтетический потенциал (АФСП),
характеризующий размеры ассимиляционного аппарата посева, время и активность
его функционирования [3, 4]. Он рассчитывается по следующей формуле:
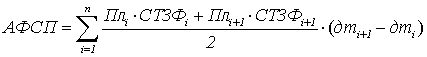 , где
, где
АФСП – Активный
фотосинтетический потенциал;
Плi – площадь ассимиляционной поверхности в
начале i-го
периода;
ПЛi+1 – площадь
ассимиляционной поверхности в конце i-го периода;
СТЗФi – скорость тушения замедленной
флуоресценции в начале i-го периода;
СТЗФi+1 – скорость
тушения замедленной флуоресценции в конце i-го периода;
дтi+1 ‒
дтi – количество
дней i-го
периода;
n – количество периодов (количество
отборов).
Активный фотосинтетический потенциал характеризуется очень тесной
корреляционной связью с продуктивностью посевов.
Структура фотосинтетического
потенциала –
характеристика, отражающая вклад каждого органа в фотосинтез растения за
определенный период роста и развития или за вегетацию в целом. Вычисляется в
процентах от общего фотопотенциала (ПФСП, ХФСП и АФСП).
Наши исследования по изучению структуры фотосинтетических потенциалов
посевов озимой пшеницы сортов, различающихся по морфофизиологическим признакам
и выращиваемых на различных фонах минерального питания, показали, что на вклад
отдельных органов растений в общий фотосинтез для ПФСП и ХФСП большое влияние
оказывают как генетические особенности, так и условия выращивания [4-7].
Следует отметить, что у активного фотосинтетического потенциала доля участия
каждого органа в общем АФСП не имеет сортовых закономерностей.
Чистая продуктивность фотосинтеза (ЧПФ) ‒ показатель, характеризующий
количество общей биомассы (сухой), образованной единицей фотосинтетического
аппарата растений (площадью ассимиляционной поверхности или количеством
хлорофилла) в течение суток. Среднюю продуктивность работы посева за весь
период вегетации можно определить путем деления биологического урожая (общая
биомасса) на величину фотосинтетического потенциала. ЧПФ так же можно
рассчитать в отдельные промежутки роста и развития растений путем деления
среднесуточного прироста биомассы на среднюю площадь ассимиляционного аппарата
(или количества хлорофилла) за этот период:
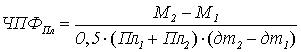 ,
,
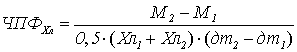 , где
, где
ЧПФПл – чистая продуктивность фотосинтеза,
рассчитанная на единицу площади ассимиляционной поверхности (г/м2 в
сутки);
ЧПФХл – чистая продуктивность фотосинтеза,
рассчитанная на единицу хлорофилла (г/г в сутки);
М1 и М2 – сухая биомасса
посева (г/м2) в начале и в конце периода, за который рассчитывается
ЧПФ;
Пл1 и Пл2 – площадь
ассимиляционной поверхности (м2/м2) в начале и в конце
периода, за который рассчитывается ЧПФ;
Хл1 и Хл2 – количество
хлорофилла (г/м2) в начале и в конце периода, за который
рассчитывается ЧПФ;
дтi+1 ‒ дтi – количество дней периода.
Таким образом, у исследователей имеется достаточно большое количество
показателей, с помощью которых можно достаточно полно, всесторонне и точно
охарактеризовать фотосинтетическую продуктивность растений сельскохозяйственных
культур. Это позволяет дать объективную оценку отзывчивости посевов на
различные технологические приемы и воздействие факторов окружающей среды, а так
же использовать полученные результаты в селекционном процессе при создании
новых сортов с высоким потенциалом продуктивности.
Литература:
1.
Третьяков Н.
Н., Карнаухова Т. В., Паинчкин Л. А. и др. Практикум по физиологии растений/
3-е изд., перераб. и доп. М.: Агропромиздат, 1990. 271 с.
2.
Наполова
Г.В., Лобков В.Т. Способ определения хлорофилла в растениях гречихи. Патент на
изобретение RU 2244916. 2003.
3.
Ерошенко
Ф.В. Замедленная флуоресценция и фотосинтетическая продуктивность сортов озимой
пшеницы. В сборнике: Физиология озимой пшеницы при интенсивной технологии
возделывания. Сборник научных трудов Ставропольского научно-исследовательского
института сельского хозяйства. Ставрополь, 1992. С. 62-71.
4.
Ерошенко
Ф.В. Продуктивность озимой пшеницы в зависимости от фотосинтетической
деятельности для зоны неустойчивого увлажнения Северного Кавказа. Диссертация
на соискание ученой степени кандидата сельскохозяйственных наук. Ставрополь,
2001.
5.
Дуденко Н.В.
Хлорофилльные фотосинтетические потенциалы и некоторые другие показатели
продукционных процессов у высокорослых и полукарликовых сортов озимой пшеницы.
Диссертация на соискание ученой степени кандидата биологических наук.
Ставрополь, 2001.
6.
Петрова
Л.Н., Ерошенко Ф.В., Нешин И.В., Дуденко Н.В. Активность фотосинтетического
аппарата различных по продуктивности сортов озимой пшеницы // Доклады
Российской академии сельскохозяйственных наук. №2. 2002. С. 11-13.
7.
Ерошенко
Ф.В. Фотосинтетическая продуктивность растений озимой пшеницы высокорослых и
низкорослых сортов. Диссертация на соискание ученой степени доктора
биологических наук / ГОУВПО «Воронежский государственный университет». Воронеж,
2011.