В. О. Саліонов
Запорізький державний медичний університет
Синтез нових 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів
Вступ. Останнім часом хіміки-синтетики
приділяють велику увагу пошуку біологічно активних речовин в ряду похідних
3-тіо-1,2,4-тріазолу. Привертають інтерес біциклічні похідні даної
гетероциклічної системи, так як сполуки цього класу здатні проявляти
протимікробну, протигрибкову, противірусну і інші види активностей [1, 4, 5].
Тому, метою дослідження був
синтез 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів
та встановлення будови сполук.
Матеріали і методи дослідження. Дослідження
фізико-хімічних властивостей проводили згідно методів, які наведені у Державній
Фармакопеї України.
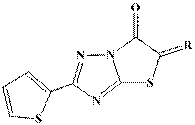
5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-они (4-6)
А. Суміш 0,01 моль 2-((5-(2-тієніл)-2H-1,2,4-тріазол-3-іл)тіо)ацетатної кислоти (1), 0,01 моль натрій ацетату
безводного, 0,01 моль відповідного альдегіду (4-бромбензальдегід,
3-нітробензальдегід, 3,4-диметоксібенз-альдегід), 20 мл ацетатної кислоти та 5
мл ангідриду ацетатної кислоти кип’ятять 2 год, виливають у дистильовану воду,
осади сполук відфільтровують. Отримані таким чином індивідуальні речовини (4-6)
жовтого кольору, важко розчинні у воді і органічних розчинниках. Для аналізу
речовини перекристалізовано з 1,4-діоксану.
Б. Суміш 0,01 моль 2-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-ону
(2), 0,01 моль натрій ацетату безводного, 0,01 моль відповідного альдегіду
(4-бромбензальдегід, 3-нітробензальдегід, 3,4-диметоксібензальдегід), 20 мл
ацетатної кислоти та 5 мл ангідриду ацетатної кислоти кип’ятять 2 год,
виливають у дистильовану воду, осади сполук (4-6) відфільтровують.
В. Суміш 0,01 моль метилового естеру
2-((5-(2-тієніл)-2H-1,2,4-тріазол-3-іл)тіо)ацетатної
кислоти (3), 0,01 моль натрій ацетату безводного, 0,01 моль відповідного
альдегіду (4-бромбензальдегід, 3-нітробензальдегід, 3,4-диметоксібензальдегід)
та 20 мл ацетатної кислоти кип’ятять 4 год, виливають у дистильовану воду,
осади відфільтровують. Таким чином отримують сполуки (4-6).
Результати
та їх обговорення. Для синтезу відповідних 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів
(4-6) було використано декілька методів (рис. 1), в яких використовувався в
якості основи безводний натрій ацетат [3].
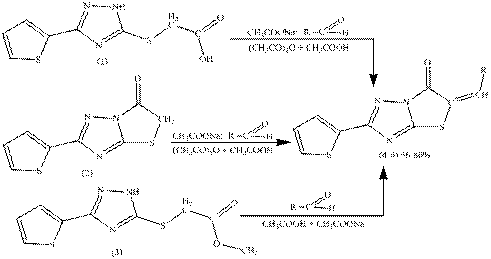
R=C6H4-4-Br, C6H4-3-NO2, C6H4-3,4-OCH3
Рис. 1. Схема синтезу 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів
(4-6)
Так, в першому випадку взаємодією 2-((5-(2-тієніл)-2H-1,2,4-тріазол-3-іл)тіо)ацетатної кислоти (1) з ароматичними
альдегідами (4-бромбензальдегід, 3-нітробензальдегід,
3,4-диметоксібензальдегід) в середовищі оцтовий ангідрид:оцтова кислота у
співвідношенні 1:4 отримані 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-они
(4-6). В другому випадку взаємодією 2-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-ону (2) з альдегідами за аналогічних
умов також отримані сполуки 4-6. Третій метод передбачає взаємодію метилового
естеру 2-((5-(2-тієніл)-2H-1,2,4-тріазол-3-іл)тіо)ацетатної
кислоти (3) з відповідним альдегідом в середовищі оцтової кислоти з додаванням
натрій ацетату, що приводить до утворення сполук 4-6. Сполуки 4-6 отримані за
трьома методами не дають депресії температури плавлення.
Отримані сполуки 4-6 є
індивідуальними жовтими кристалічними речовинами не розчинними у воді, мало розчинними в органічних
розчинниках та розчинними у мінеральних кислотах. Для аналізу синтезовані
сполуки очищені кристалізацією з 1,4-діоксану.
Фізико-хімічні константи сполук 4-6 наведені в таблиці 1. Будова сполук 4-6 підтверджена
комплексним використанням сучасних інструментальних методів аналізу. Дані
хімічних зсувів протонів в 1Н
ЯМР спектрах сполук 4-6 наведені в таблиці 2.
Таблиця 1
Фізико-хімічні константи 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів (4-6)
|
Сполука |
R |
Т.п., оС |
Бруто-формула |
Вихід, % |
m/z MH+ |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
4 |
4-бромбензіліден |
265-267 |
C15H8BrN3ОS2 |
56 |
390,0 |
|
5 |
3-нітробензіліден |
218-220 |
C15H8N4О3S2 |
80 |
357,0 |
|
6 |
3,4-диметоксі-бензіліден |
246-248 |
C17H13N3О3S2 |
72 |
372,0 |
Продовж.
табл. 1
|
Сполука |
Знайдено, % |
Обчислено, % |
||||||
|
C |
H |
N |
S |
C |
H |
N |
S |
|
|
1 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
4 |
46,10 |
2,08 |
10,75 |
16,40 |
46,16 |
2,07 |
10,77 |
16,43 |
|
5 |
50,58 |
2,27 |
15,73 |
17,97 |
50,55 |
2,26 |
15,72 |
17,99 |
|
6 |
55,05 |
3,54 |
11,33 |
17,24 |
54,97 |
3,53 |
11,31 |
17,27 |
В 1Н ЯМР спектрі
5-(3,4-диметоксібензіліден)-2-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-ону (6) реєструються сигнали протонів –CH3 груп у вигляді синглету, які резонують при 3,88 м.ч. (6H), сигнали протонів ароматичного кільця у вигляді дублету при 6,81 м.ч. (1H), сигнал протону –СН-групи при 8,21 м.ч. у вигляді синглету, сигнали
протонів ядра тіофену у вигляді двох однопротонних
дублетів при 7,77 м.ч. та при 7,88 м.ч.
Також спостерігаються сигнали протонів ароматичного циклу, які спільно резонують з
протоном тіофену у вигляді мультиплету при 7,22 м.ч. (рис. 2) [2].
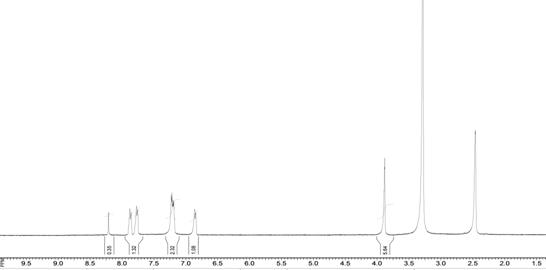
Рис. 2. 1Н-ЯМР-спектр 5-(3,4-диметоксібензіліден)-2-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-ону (6)
Таблиця 2
Дані хімічних зсувів протонів в 1Н ЯМР спектрах 5-R-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-онів (4-6)
|
Сполука |
1H ЯМР (DMSO-d6 δ ppm) |
|
4 |
7,19 (t, 1H, Thiophene-H), 7,57 (q, 2H, Ar-H), 7,68 (d, 1H,
Thiophene-H), 7,77 (m, 2H, Ar-H, 1H, Thiophene-H), 8,22
(s, 1H, CH) |
|
5 |
7,22 (t, 1H, Thiophene-H), 7,82 (m, 1H, Ar-H,
2H, Thiophene-H), 8,12 (d, 1H, Ar-H), 8,34 (d, 1H, Ar-H), 8,41 (s,
1H, CH), 8,58 (s, 1H, Ar-H) |
|
6 |
3,88 (s, 6H, CH3), 6,81 (d, 1H, Ar-H), 7,22 (m, 2H,
Ar-H, 1H, Thiophene-H), 7,77 (d, 1H, Thiophene-H), 7,88 (d, 1H,
Thiophene-H), 8,21 (s, 1H, CH) |
Висновки. Таким
чином, трьома методами вперше синтезовано 5-(R-іліден)-(2-тієніл)тіазоло[3,2-b][1,2,4]тріазол-6(5H)-они
(4-6), будова яких підтверджена
комплексним використанням сучасних інструментальних методів аналізу.
Література:
1.
Бігдан О. А. Синтез, фізико-хімічні та
біологічні властивості похідних 1,2,4-тріазол-3-тіонів, які містять
фторфенільні замісники: дис. … канд. фармац. наук. – Запоріжжя, 2015. – 205 с.
2.
Казицына Л. А. Применение УФ-, ИК-, ЯМР- и МАСС-спектроскопии
в органической химии / Л. А. Казицына. – 2-е изд., перераб. и доп. – М. :
Изд-во Моск. ун-та, 1979. – 236 с.
3.
Ли Дж. Именные реакции. Механизмы
органических реакций / Ли Дж. ; [пер. с англ. В. М. Демьянович]. – М.
: БИНОМ. Лаборатория знаний, 2006. – 456 с.
4.
Панасенко О. І. Синтез, перетворення,
фізико-хімічні та біологічні властивості аміно- і тіопохідних 1,2,4-тріазолу :
дис. … д-ра фармац. наук / Панасенко О. І. – К., 2005. – 396 с.
5.
Парченко В. В. Синтез, перетворення, фізико-хімічні та
біологічні властивості в ряді 5-фурилзаміщених 1,2,4-тріазол-3-тіонів:
Дис. д-ра фармац. наук. – Запоріжжя,
2014. – 683 с.