Панасенко О. І., Кремзер О. А., Самура Т. О., Мельник І. В., Гоцуля А. С., Саліонов В. О., Сафонов А. А, Щербіна Р.
О., Буряк В. П., Куліш С. М., Постол Н. А., Панасенко
Т. В.
Запорізький державний медичний університет, Україна
ЕЛЕКТРОННІ
СПЕКТРИ ПОГЛИНАННЯ ФУРОСЕМІДУ
В молекулі
фуросеміду фурановий цикл не є супряженим із субстітуєнтами (рис. 1)
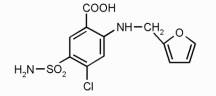
Рис. 1.
Структурна формула фуросеміду.
Згідно даним
наукової літератури для не заміщеного фурана та його одинадцяти похідних в
етанольних розчинах спостерігається одна смуга поглинання з максимумами в межах
212
- 238 нм [3] і позначається умовно як
«фуранова». Так як «фуранова» смуга є мало характерною, основні смуги
поглинання фуросеміду безумовно залежать від хромофорів , які знаходяться у субстатієнтах
(π→ π ̽ бензольних циклів та р–π–супряження цього
циклу з замісниками).
Для більш повного
пояснення походження УФ–спектрів та їх характера від будови вивчаємої сполуки були виміряні електронні спектри
поглинання модельних сполук : бензойна кислота (І), антранілова кислота (ІІ) та
п-амінофенілсульфаніламід (ІІІ) в етанольних розчинах. У якості розчинників для
дослідження спектрів поглинання фуросеміду були використанні : вода, 95 %
етанол, 0,1 М HCl, 0,1М NaOH, циклогексан, діоксан, хлороформ, концентрована сірчана
кислота. (табл. 1)
Для бензойної
кислоти ми встановили в етанольному розчині наявність високоінтенсивного
максимуму поглинання при 226 нм та середньої
інтенсивності при 273 нм (табл.1). Перший максимум
розглядається як результат р–π–супряження в бензольному хромофорі [5].
У випадку
антранілової кислоти супряження, внаслідок чого відбувається батохромне
зміщення максимума на 21 нм (табл.1) р-π–супряження в молекулі модельної
речовини (ІІ) спричиняє подальше батохромне зміщення, так як за данними Scott [5]. Електродонори субстатуенти у п-положенні
більш активно долучаються до ланцюга супряження.
Таблиця 1
СПЕКТРАЛЬНА
ХАРАТКЕРИСТИКА ФУРОСЕМІДУ
|
№ |
Досліджувана сполука |
Концентрація,розчинник |
λ, нм |
Ε |
Lg E |
Перехід електронів |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1. |
Бензойна кислота |
8,1*10-5 м етанол |
226 273 |
10720 813 |
4,03 2,91 |
р- π –супряження Lb -смуга |
|
2. |
Антранілова кислота |
7,3*10-5м етанол |
330 |
4170 |
3,62 |
Lb -смуга |
3. |
n-Амінофеніл сульфаніламід |
5,8*10-5м етанол |
262 295 |
14790 |
4,17 |
р- π –супряження Lb –смуга |
|
4. |
Фуросемід |
3,0*10-5 м вода |
229 277 330 |
30900 20420 5010 |
4,49 4,31 3,70 |
р- π –супряження р-
π –супряжен-ня, La-смуга Lb-смуга |
|
5. |
Фуросемід |
3,0 *10-5 м 0,1 М NaOH |
227 270 335 |
33880 18200 4870 |
4,53 4,26 3,63 |
р- π –супряження накладення р- π –супряження та La-смуги Lb -смуга |
|
6. |
Фуросемід |
3,0 *10-5 м 0,1 М HCl |
234 274 340 |
44670 20420 5620 |
4,65 4,31 3,75 |
р- π –супряження накладення р- π –супряження та La–смуги Lb–смуга |
|
7. |
Фуросемід |
3,0 *10-5 м Конц H 2 SO4 |
247 283 291 355-360 470 |
16220 4570 5010 7760 9120 |
4,21 3,66 3,70 3,89 3,96 |
р- π –супряження накладення р- π –супряження та La–смуги Lb –смуга р-π–супряження |
8. |
Фуросемід |
3,0 *10-5 м етанол |
230 274 334 |
34670 19950 4470 |
4,54 4,30 3,65 |
р- π –супряження накладення р- π –супряження та La–смуги Lb –смуга |
|
9. |
Фуросемід |
3,0 *10 -5м циклогексан |
234 271 335 |
9330 4070 150 |
3,97 3,61 3,06 |
р- π –супряження накладення р- π –супряження та La–смуги Lb –смуга |
|
10 |
Фуросемід |
3,0 *10 -5м діоксан |
234 273 345 |
42660 19500 5620 |
4,63 4,29 3,75 |
р- π –супряження накладення р- π –супряження та La–смуги Lb –смуга |
|
11 |
Фуросемід |
3,0 *10 -5 м хлороформ |
275 345 |
19500 5250 |
4,29 3,72 |
р- π –супряження накладення La–смуги Lb –смуга |
Друга смуга
поглинання модельних сполук І–ІІІ з λмакс 273 - 330 нм відповідає локальному збудженню
бензольних циклів, тобто відповідає 1Lb –смузі за
номенклатурою, яка запропонована Klevens, Platt [4].
В УФ–спектрах
фурасеміду спостерігається , як правило, три смуги поглинання (див.табл.1).
Перша смуга з λмакс = 227 -
235 нм відповідає р–π–супряженню у заміщеному
бензольному хромофорі. При переході від малополярних розчинників (в
циклогексані та діоксані) λмакс = 234 нм)
Друга смуга
поглинання з максимумами в межах 270 - 277 нм слід розглядати як результат
накладання р-π–супряження в n-амінофенілсульфонільному
хромофорі та π→ π* переходу електронів (La- смуга).
Про це свідчить батохромне зміщення λмакс при переході від
малополярних до більш полярних розчинників (λмакс в
циклогексані 271 нм, в діоксані 273 нм, в етанолі 274 нм, у воді 277 нм).
Як відомо (2),
батохромне зміщення смуг із збільшенням полярності розчинників характерно для
π→π*-переходів у зв’язку із збільшенням дипольного моменту
молекули.
Третя смуга
поглинання фуросеміду λмакс в межах 330 - 345 нм відповідає 1Lb – смузі,
аналогічно як у випадку з антраніловою кислотою.
Фуросемід є амфотерною сполукою і його
спектри як у 0,1 М розчині натрію гідроксиду, так і у 0,1М розчині хлоридної
кислоти мало відрізняються від спектрів водних розчинах.
У концентрованій
сірчаній кислоті відбуваються значні зміни в молекулі фуросеміду, в результаті
чого виникає 5 максимумів поглинання, з
яких найбільш характерним є довгохвильовий максимум при 470 нм.
Слід зробити
висновок , що окрім солеутворення по атому азоту, відбувається також утворення
солей оксонію (див. табл.1)
ВИСНОВКИ
1. Вивчені
УФ–спектри поглинання фуросеміду у розчинниках різної полярності (вода, етанол
95%, 0,1М NaOH, 0,1 М HCl ,
концентрована сірчана кислота, циклогексан, діоксан, хлороформ) та модельних
сполук (кислота бензойна, кислота антраніловаш, n-амінофенілсульфоніл) в етанольних розчинах.
2. Встановлено, що Фуросемід характеризується трьома смугами
поглинання з λмакс в
межах 227
- 235, 270 - 277 та 330
- 345 нм.
3. Найбільш
характерними в УФ-спектрах фуросеміду є дві останні смуги, що обумовленні
π→π* переходами електронів 1La та 1Lb смуги).Слід зазначити, що у першому випадку є накладання
р–π–супряження в n–амінофенілсульфонільному хромофорі.
ЛІТЕРАТУРА
1. Лекарственные препараты Украины. Министерство
здравоохранения Украины / А. Н.
Беловол, В. А. Теоргиянц, О. М. Гладченко и др.; под ред. В. П.
Черных, И. А. Зупанца. – Харьков:
Изд-во НФаУ // Золотые страницы, 2005. – 512 с.
2. Сайдов Г. В. Практическое руководство по молекулярной спектроскопии /
Г. В. Сайдов, О. В. Свердлова // Л.:
Изд-во ЛГУ, 1980. – 136 с.
3. Штерн Э. Электронная абсорбционная
спектроскопия в органической химии / Э. Штерн, К. Тиммонс // М.: Мир, –1974,
296 с.
4.
Klevens H. B. Spectral resemblances of catacondened hydrocarbons/ H. B.
Klevens, I. R. Platt // J. Сhem.
Phys. – 1949. – Vol.
17, № 5. – Р. 470 – 481.
5.
Scott A. I. The electron transfer absorption of substituted benzenes / Scott A.
I. / Experientia. – 1961. – Vol. 17.
– № 2. – Р. 68 – 69.