Биологические науки / 8.Физиология человека и животных.
К. м. н. Козак М. В.
Астраханский
государственный университет,
Россия, 414000. Город
Астрахань, пл. Шаумяна, 1.
ИССЛЕДОВАНИЕ доз эмоксипина
для
получения антиоксидантных эффектов, сопоставимых с действием α–токоферола и ионола
Рядом исследований доказано, что в реакциях перекисного окисления
липидов имеются определённые половые различия (Тёплый Д.Л., 1984; Сейфулла
Р.Д., Борисова И.Г., 1990; Кондратенко Е. И., 1996; Выставной А.Л., Золин П.П.,
1999). Существуют доказательства зависимости эффектов воздействия
α-токоферола от стероидного профиля животных разного пола (Тёплый Д.Л.,
1984; Котельников А.В., 1997).
При постановке данных экспериментов нами учитывались циклические
изменения уровня половых гормонов у самок, связанные с периодическими
колебаниями функциональной активности гипоталамуса и гипофиза (Бабичев В.Н.,
1984 и другие).
При сравнительном изучении влияния α-токоферола и
синтетических антиоксидантов необходимо было предварительно определить дозы
воздействия эмоксипина для достижения сопоставимых с действием α-токоферола и ионола
эффектов. При этом учитывалось прооксидантное действие повышенных
доз этих препаратов.
Ранее, другими авторами, исследование
влияния ионола проводились на беспородных самцах мышей (Миненкова Е.А и др.,
1996), а также мышах линии F1 (Вартанян
Л.С., Гуревич С.М. 1999), монгольских песчанках (Фёдорова Т.Н. и др., 1999).
Опыты с введением ионола белым крысам также проводились (Кондратенко Е.И.,
1996, Котельников А.В., 1997). Выраженный антиоксидантный эффект в этих
исследованиях отмечался при введении 2,
3, 4 мг/100г массы животных, при введении 10мг/100г – прооксидантный эффект
воздействия. Сведения о дозах применения эмоксипина в опытах на белых крысах
отсутствуют. В наших экспериментах для постановки опытов была выбрана доза
ионола 4 мг/100г массы животного.
Эмоксипин – препарат из группы 3–оксипиридинов (Смирнов Л.Д.,
Дюмаев К.М., 1984, 1989). В течение ряда лет он успешно используется в лечебной
практике, главным образом, в офтальмологии. В остром периоде инфаркта миокарда
эмоксипин вводился внутривенно капельно по 10 мг/кг в сутки в течение 5 дней,
затем внутримышечно по 1 мг/кг в течение 15 дней (Голиков А.П. и др., 1990).
Отмечено ускорение репаративных процессов и уменьшение зоны некроза. Было
установлено, что эмоксипин эффективно ингибирует перекисное окисление
липидов, проявляя также свойства универсального стабилизатора мембранных
структур клетки (Смирнов Л.Д.,
1993). Испытание антимутагенных свойств эмоксипина проводилось на мышах
линии СВА/С57В16 (Урываева И.В. и др., 1996). Разовая доза эмоксипина при
внутрибрюшинной инъекции составляла 25 мг/кг, при дозе острой токсичности для
мышей ЛД50 = 241 мг/кг.
Материал и методы. Опыты по исследованию действия α – токоферола, как регулятора гонадотропной функции аденогипофиза, были поставлены на половозрелых белых крысах линии «Вистар», средней массой: 230г (самцы) и 200г (самки). Возраст животных - восемь месяцев. Животные содержались в виварии при температуре 20-22˚C в стандартных лабораторных условиях (самцы и самки раздельно).
В ходе эксперимента и непосредственно перед его завершением изучались влагалищные мазки с целью определения фазы эстрального цикла (Киршенблат Я.Д., 1973). Исследования проводились в период относительного «гормонального покоя» самок, когда организм обладает наибольшей чувствительностью к воздействию экзогенных антиоксидантов, то есть в фазы диэструса и метаэструса. Декапитацию животных проводили под хлоралгидратным наркозом внутрибрюшинно (2,5% раствор, 1мл / 100г массы животного). Фиксация соответствующих участков мозга проводилась по «СУЗА» (Ромейс Б., 1953). Окраска целлоидинпарафиновых срезов осуществлялась крезазаном (Ромейс Б., 1953), с использованием других руководств по микроскопической технике (Роскин Г.И., Левинсон Л.Б., 1957; Микроскопическая техника, 1996). Измерение клеток и ядер (Автандилов Г.Г., 1973) проводилось с помощью светового микроскопа и винтового окулярмикрометра МОВ – 1- 15x при увеличении микроскопа 15×90.
Гонадотропоциты аденогипофиза имеют эллипсовидную форму, в связи с этим объём клеток и их ядер в кубических микрометрах вычислялся с помощью формулы расчёта объёма эллипсоида
v = ![]() 2,
2,
где a – наибольший диаметр оси эллипсоида, b – наименьший диаметр оси эллипсоида. Оси измеряли в плоскости оптического среза, проходящего через ядрышко (Гейнисман, 1974). Количество клеток для анализа по каждому варианту составило не менее 150 – 200.
Полученные результаты обработаны статистически с использованием t-критерия Стьюдента, критерия λ (лямбда) А.Н. Колмогорова – Н.А. Смирнова (Плохинский, 1980, Лакин, 1990) и метода альтернативного анализа.
Оценка
антиоксидантного действия различных доз эмоксипина проводилось по изменению
уровня малонового диальдегида в печени крыс. В качестве контрольных
использовалась группа животных, которым вводился α-токоферол в дозе 1
мг/100г массы. Эмоксипин вводился внутримышечно, α-токоферол – энтерально.
Результаты и
обсуждение. До проведения
экспериментов нами было проведено сравнительное тестирование различных доз
эмоксипина для исследования антиоксидантного эффекта, на самцах белых крыс.
Дозы эмоксипина для тестирования были выбраны соответственно проведённым
исследованиям на мышах: 25мг/кг, 10 мг/кг, кроме того, тестировались и
дополнительные дозы – 5 и 2,5 мг/кг (или соответственно – 2,5мг/100г, 1мг/100г,
0,5мг/100г, 0,25мг/100г массы животного).
В результате проведённого эксперимента было
установлено (табл. 1), что наименьший уровень МДА в гомогенатах печени
определялся при действии эмоксипина в дозе 0,5мг/100г.
Таблица 1
Влияние
различных доз эмоксипина (ЭМ)
на
уровень малонового диальдегида в печени самцов белых крыс
(нмоль на 0,5 г сырого
веса печени)
|
№ группы |
Вариант опыта, антиоксидант |
Доза воздействия |
Коли- чество животных |
Уровень МДА в печени |
|
1 |
α - токоферол |
1мг/100г |
10 |
1,17 ± 0,05* |
|
2 |
Эмоксипин |
2,5мг/100г |
10 |
1,75 ± 0,08* |
|
3 |
Эмоксипин |
1мг/100г |
10 |
1,45 ± 0,07* |
|
4 |
Эмоксипин |
0,5мг/100г |
10 |
0,77 ± 0,03* |
|
5 |
Эмоксипин |
0,25мг/100г |
10 |
1,72 ± 0,08* |
Этот уровень МДА оказался ниже, чем при введении
α-токоферола в дозе 1мг/100г массы животного (р<0,001). Доза эмоксипина
0,25мг/100г оказалась недостаточной для достижения антиоксидантного эффекта, а
с возрастанием дозы эмоксипина – 1мг/100г и 2,5мг/100г проявляется
прооксидантный эффект эмоксипина. В связи с этим, для проведения дальнейших
исследований, была выбрана доза 0,5мг/100г массы животного, как оптимальная.
Оценка перекисного
окисления липидов во втором цикле опытов
проводилась на основании изменений уровня МДА в печени крыс при введении
α-токоферола, эмоксипина, ионола, воздействии гонадоэктомии (ГЭ) и при
сочетании действия гонадоэктомии с введением α-токоферола (ГЭ+Е) и
синтетического антиоксиданта эмоксипина.
Результаты опытов показали (рис. 1), что уровень МДА в
печени самцов белых крыс достоверно превышает значение этого показателя у самок
(p < 0,001). Введение α-токоферола привело к уменьшению МДА в печени самцов в 1,5
раза, самок почти в 2 раза в сравнении с контролем (p < 0,001). При этом влияние пола на уровень МДА
оставались существенным и достоверным (р < 0,001). Введение эмоксипина вызвало уменьшение содержания
МДА у самцов 2,3 раза, а у самок в 1,5
раза (p < 0,001). Ещё более значительное снижение уровня
МДА в опытах отмечено после воздействия ионола
у животных обоего пола (p < 0,001).
В результате действия синтетических антиоксидантов,
наряду с достоверным снижением уровня перекисного окисления липидов, происходит
выравнивание уровня МДА у самцов и самок с нивелированием половых различий по этому
показателю, так как синтетические антиоксиданты сильнее снизили уровень МДА у
самцов.
После гонадоэктомии
уровень МДА в печени существенно снизился у животных обоих полов (p < 0,001), особенно у самцов. Самый низкий уровень
МДА отмечен в печени белых крыс при комбинированном воздействии
α-токоферола и эмоксипина на фоне гонадоэктомии.
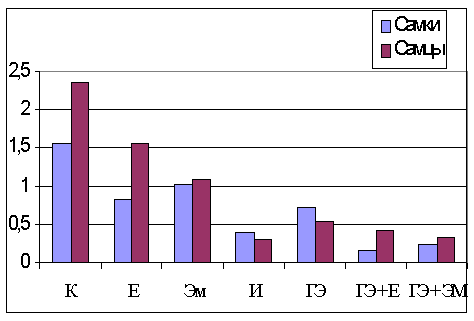
Рис. 1. Уровень малонового диальдегида в печени
белых крыс
( нмоль на 0,5 г сырого веса
печени)
Исследование уровня перекисного окисления липидов
показало, что α-токоферол, эмоксипин и ионол, проявляя свои
антиоксидантные свойства, снижают уровень МДА в гомогенатах печени крыс.
Исходные отличия уровня ПОЛ у самцов и самок сохраняются при введении
α-токоферола и нивелируются при действии ионола и эмоксипина, так как синтетические
антиоксиданты сильнее снижают уровень ПОЛ у самцов. Дополнительное введение
α-токоферола и эмоксипина, усиливая эффект гонадоэктомии, однонаправленно
снижают уровень ПОЛ, различий в действии антиоксидантов различной природы при
этом не наблюдается.
В результате проведенных исследований нами
было установлено (Козак М.В., 2000) что действие α-токоферола и
синтетических антиоксидантов, в дозах соизмеримых с терапевтическими, приводит
к уменьшению уровня перекисного окисления липидов в плазме крови и гомогенатах
печени животных. Изначальные половые различия уровня перекисного окисления
липидов (ПОЛ), имеющиеся у интактных животных, сохраняются при введении
α-токоферола и нивелируются под влиянием синтетических антиоксидантов за
счёт более выраженного снижения ПОЛ у самцов.
Литература
1. Бабичев В.Н.
Нейроэндокринология пола.- М.: Наука, 1981.- 224 с.
2. Бабичев В.Н.
Нейрогормональная регуляция овариального цикла.- М.: Медицина, 1984. 240 c.
3. Бабичев В.Н.
Нейроэндокринная регуляция репродуктивной системы.- Пущино, 1995.-227 с.
4. Вартанян
Л.С., Гуревич С.М. Влияние ионола на метаболизм супероксидных радикалов в
печени мышей // Вопросы медицинской химии.- 1999.- № 4.- Электронная версия
журнала.
5. Выставной
А.Л., Золин П.П. Перекисное окисление липидов в секрете копчиковой железы кур
// Материалы Международной конференции, посвящённой 150-летию И.П. Павлова
«Механизмы функционирования висцеральных систем»: Тезисы докладов. РАН.–
Санкт-Петербург. Россия, 1999.– С. 81.
6.
Голиков А.П.,
Овчинников А.Л., Полумисков А.Ю. Антиоксидант эмоксипин: влияние на
формирование очага некроза и репаративные процессы при инфаркте миокарда //
Кардиология.- 1990.- № 7.- С. 50-53.
7. Дюмаев К.Н.
Антиоксиданты в профилактике и терапии патологии центральной нервной системы.-
М.: Институт биологической химии РАМН, 1995. -С. 7-29.
8. Капралов
А.А., Петрова Г.В., Васильева С.М., Донченко Г.В. Модуляция токоферолом
действия А23187, верапамила и форбол- миристат- ацетата на РНК- полимеразную
активность изолированных ядер печени крыс // Биохимия.- 1997.- Т. 62, вып. 7.-
С. 814-816.
9. Козак М.В.
Гонадотропная функция аденогипофиза при гипервитаминозе – Е. Монография / М.В.
Козак.- Астрахань: Изд. дом «Астраханский университет», 2007. – 91 с.
10. Кондратенко
Е.И. Исследование влияния естественного и синтетического антиоксидантов на
функцию щитовидной железы: Дис. канд. биол. наук.- Астрахань, 1996.- 181 с.
11. Котельников
А.В. Роль натурального и синтетического антиоксидантов в регуляции
проницаемости гистогематических барьеров гипоталамо-гипофизарно-тиреоидной
системы белых крыс: Дис. канд. биол. наук.- Астрахань, 1997.– 112 с.
12.
Микроскопическая
техника. Руководство для врачей и лаборантов. Ред. Д.С. Саркисов и Ю.Л.
Петров.- М.: РАН. Медицина, 1996.- 543 c.
13. Миненкова
Е.А., Барсель В.А., Пичугин В.В., Гаранина А.Б., Евтеева Н.М., Парамонова М.Ю.,
Майкова Г.Г. Дозозависимые эффекты комбинации антиоксидантов на примере
дибунола и бета-каротина // Известия РАН. Серия биологическая.- Маик: Наука,
1996.- № 2.- С. 147-152.
14. Сейфулла
Р.Д., Борисова И.Г. Проблемы фармакологии антиоксидантов // Фармакология и
токсикология.- 1990.- Т. 53, № 6.- С. 3-10.
15. Смирнов Л.Д.
О производных 3-оксипиридина // Биоантиоксиданты. Мат. конф. М., 1993.- С. 130.
16. Смирнов Л.Д.,
Дюмаев К.М. Некоторые актуальные направления поиска мембраноактивных соединений
и лекарственных препаратов на их основе // Вестник Акад. мед. наук.– 1984.- №
4.- С. 89.
17. Смирнов Л.Д.,
Дюмаев К.М. Целенаправленный синтез биологически активных соединений на основе
β-оксипроизводных азотистых гетероциклов // Целенаправленные изыскания
физиологически активных веществ: Мат. конф. Рига, 1989.- С. 5.
18. Тёплый Д.Л.
Исследование влияния витамина Е на функциональные системы организма: Дис. докт.
биол. наук.– Астрахань, 1984.- 434 с.
19. Урываева
И.В., Делоне Г.В., Смирнов Л.Д. Изучение мутагенных и модифицирующих свойств
эмоксипина с помощью анализа микроядер в клетках печени // Известия РАН. Серия
биологическая.- Маик: Наука, 1996.- № 1.- С. 5-9.
20. Фёдорова
Т.Н., Болдырев А.А., Ганнушкин И.В. Перекисное окисление липидов при
экспериментальной ишемии мозга // Биохимия.- Маик: Наука, 1999.- Т. 64, вып.
1.- С. 94-98.