Столярова
Е.А. Столярова Т.А.
Белорусский государственный медицинский университет,
Минск
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ
ХАРАКТЕРИСТИКА ВАРИАБЕЛЬНЫХ ОБЛАСТЕЙ ПРОТИВОВИРУСНЫХ АНТИТЕЛ БОЛЬНЫХ ГЕПАТИТОМ
С.
Вирусный
гепатит С - одна из наиболее серьезных и актуальных проблем современного
здравоохранения и медицинской науки. В мире от данной инфекции страдает более
300 млн. человек, 80% больных вирусным гепатитом С имеют хроническую форму,
которая часто ассоциируется со злокачественными новообразованиями и криоглобулинемией.
Помимо гепатоцитов вирус поражает иммунокомпетентные клетки. [1] Эпидемиологическими исследованиями показана
высокая частота определения маркеров ВГС (анти-ВГС-антитела) у пациентов со
злокачественными В-клеточными лимфомами (9–56%). При молекулярно-генетическом анализе
В-клеточных лимфом генетический материал ВГС обнаружен в геноме опухолевых клеток. [2] Эти данные позволяют предположить, что ВГС
участвует в патогенезе злокачественных лимфом, а также может вовлекаться, как
этиологический агент в патогенез смешанной криоглобулинемии II типа.
В
генетическом контроле молекул иммуноглобулинов участвует множество генов (более
160), кодирующих константные и вариабельные области тяжелых и легких цепей
иммуноглобулинов. Перестройки данных генов и их комбинации в ходе иммунного
ответа определяют потенциально высокое разнообразие продуцируемых антител с
целью формирования противовирусного иммунитета–2,5х106. [3]
Протективной вируснейтрализующей
активностью обладают антитела к гипервариабельному домену поверхностного
гликопротеина Е2 вируса гепатита С.
Цель работы:
Изучить
характер изменений генов вариабельных областей иммуноглобулинов пациентов,
инфицированных ВГС; больных с различными ВГС-ассоциированными злокачественными
новообразованиями и аутоиммунными заболеваниями, а также пациентов,
подвергшихся лечению ВГС-ассоциированных лимфопролиферативных заболеваний.
Материалы и
методы.
В качестве материалов исследования в базах
данных (NCBI GeneBank) были выбраны последовательности вариабельных участков
иммуноглобулинов, выделенные от:
· пациентов с хроническим ВГ С, ингибирующие взаимодействие наружного гликопротеина Е2
вируса гепатита С 1а и 2b генотипов с
рецептором CD 81- CAB (13 последовательностей).
·
пациентов с ВГС-ассоциированными неходжинскими лимфомами и смешанной криоглобулинемией II типа-AAG (18 последовательностей).
· пациентов после лечения ВГС-ассоциированных
лимфопролиферативных заболеваний -AAZ (15 последовательностей).
· пациентов со смешанной криоглобулинемией
II типа и ВГ С - AAR,AAQ (5 последовательностей).
· пациентов с ВГС-ассоциированной индолентной
В-клеточной лимфомой - ААК (8
последовательностей).
Для
построения дендрограмм использовался метод попарного невзвешенного
кластирования с арифметическим усреднением (UPGMA).
При сравнении
аминокислотных последовательностей вариабельных участков иммуноглобулинов
применялся метод Identity.
Результаты
исследований:


Рис.1 Рис.2
Рисунок 1 отражает процесс включения генов
двух семейств (kv325 и kv328) в синтез вариабельных участков лёгких
цепей иммуноглобулинов. На рисунке 2 показано, что в синтезе вариабельных
участков молекул иммуноглобулинов тяжелых цепей участвуют три семейства генов (VH1;VH3 и VH4). Рассматриваемые
последовательности, выделенные от пациентов инфицированных ВГС (CAB), от пациентов с
ВГС-ассоциированными неходжинскими лимфомами (AAG), а также от пациентов, подвергшихся лечению (AAZ), составляющие один кластер, кодируются генами одного семейства.
В рассматриваемых генах вариабельных участков были проанализированы
мутационные замены нуклеотидов. При анализе мутаций принимались
во внимание замены нуклеотидов GС на АТ в третьем положении кодона,
происходящие в результате действия фермента Activation Induced Cytidine DNA
Deaminase, осуществляющего дезаминирование цитидина и гуанозина.
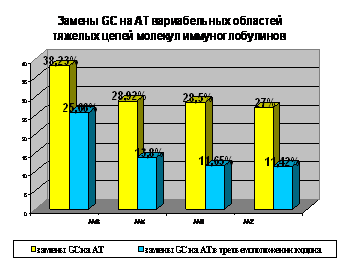
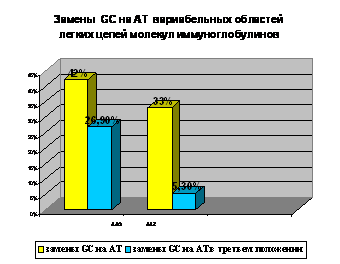 В последовательностях ААG доля замен GC на АТ составила 25,7% и 26,9% в тяжелых и легких
цепях соответственно, 13,8% замен – в генах вариабельных участков тяжелых цепей
ААК. В нуклеотидных последовательностях тяжелых цепей, выделенных от
пациентов со смешанной криоглобулинемией II типа и ВГ С (AAR и AAQ) доля замен GC на АТ составила 11,65%. В тяжелых и
легких цепях иммуноглобулинов, выделенных от пациентов после лечения
ВГС-ассоциированных лимфопролиферативных заболеваний (AAZ) доля замен GC на АТ составила 11,42% и 5,3%.
В последовательностях ААG доля замен GC на АТ составила 25,7% и 26,9% в тяжелых и легких
цепях соответственно, 13,8% замен – в генах вариабельных участков тяжелых цепей
ААК. В нуклеотидных последовательностях тяжелых цепей, выделенных от
пациентов со смешанной криоглобулинемией II типа и ВГ С (AAR и AAQ) доля замен GC на АТ составила 11,65%. В тяжелых и
легких цепях иммуноглобулинов, выделенных от пациентов после лечения
ВГС-ассоциированных лимфопролиферативных заболеваний (AAZ) доля замен GC на АТ составила 11,42% и 5,3%.
При
исследовании лёгких цепей молекул
иммуноглобулинов наблюдалась высокая степень сходства между CDR3 и CDR2 участками последовательностей, ингибирующих взаимодействие наружного гликопротеина Е2
вируса гепатита С 1а и 2b генотипов с
рецептором CD 81 (САВ) и гипервариабельными областями последовательностей AAG и AAZ (в CDR3 90,9% и 87,87%; в CDR2 82,14% и 85,7% соответственно). CDR1 участок подвергается наибольшему
количеству соматических мутаций, процент сходства последовательности AAG и AAZ с САВ составил 56,25 и 75
соответственно.
В
гипервариабельных участках тяжёлых цепей молекул иммуноглобулинов сходство с
САВ составило: в CDR1 участке для AAG-40%; AAZ-60%; AAR-60%; ААК-20%, в CDR2 участке для AAG- 94%; AAZ-94%; AAR-94%; ААК-94%. CDR3 участки последовательностей AAG, AAZ и ААК значительно отличаются от
гипервариабельных участков (CDR3) СAB, однако исследуемые
области AAG и ААК показывают высокое сходство с CDR3 участком последовательностей,
выделенных из клеток лимфом (до 81,8%).
Выводы: 1. В синтез последовательностей молекул
иммуноглобулинов,
выделенных от пациентов инфицированных ВГС (CAB), выделенных из клеток
различных ВГС-ассоциированных неходжинских лимфом, а также выделенных от пациентов, подвергшихся лечению (AAZ), составляющих один кластер,
включаются гены одного семейства. В процесс синтеза вариабельных участков
лёгких цепей молекул иммуноглобулинов происходит включение генов двух семейств
(kv325 и kv328), в синтезе вариабельных участков
тяжелых цепей участвуют гены трёх семейств (VH1;VH3 и VH4).
2.Фермент Activation Induced Cytidine DNA Deaminase наиболее активен в клетках ВГС-ассоциированных
лимфом пациентов с криоглобулинемией II типа, у пациентов после лечения
лимфопролиферативных заболеваний наблюдается наиболее низкий уровень активности
данного фермента.
3.Установлено сходство последовательностей CDR2 и CDR3 участков легких цепей, выделенных
от пациентов с ВГС-ассоциированными
неходжинскими лимфомами и
криоглобулинемией II типа (AAG) с последовательностями САВ. Особенность генов
тяжелых цепей заключается в сходстве CDR3 участков с гипервариабельными СDR3 областями иммуноглобулинов из клеток
ВГС-неассоциированных неходжинских лимфом.
Литература:
1. Н.В.Дунаев, Е.В.Эсауленко.
Структурно-функциональная организация генома вируса гепатита С. //Вопросы
вирусологии. – 2006.- Том.51. -№2. Стр.10-14.