Румянцева В.Д.1, Горшкова
А.С.1, Ивановская Н.П.2,
Осин Н.С.2, Сухин Г.М.2
1 Московский Государственный Университет Тонких
химических технологий им. М.В. Ломоносова, 119571, Москва, Россия
2 ГосНИИ биологического приборостроения, 125424, Москва,
Россия
Платиновые комплексы
порфиринов как длительно люминесцирующие маркеры для ранней диагностики
поверхностных опухолей
Одной из наиболее актуальных проблем
современной медицины является диагностика и лечение злокачественных
новообразований. Метод флуоресцентной диагностики опухолей с использованием
фотосенсибилизаторов порфиринового ряда является перспективным и успешно
развивающимся. Разрешающая способность этого метода определяется контрастностью
получаемого люминесцентного изображения опухоли на фоне окружающей ее здоровой
ткани, отношением полезного и фонового сигналов. Однако недостаточно высокий
контраст из-за фоновой люминесценции создает иногда большие трудности в
использовании данного метода. Одним из оптимальных решений преодоления этих
недостатков является поиск и изучение новых фотосенсибилизаторов,
люминесцентные характеристики которых позволили бы их избежать.
Создание реагентов, методов и аппаратуры
для ранней люминесцентной диагностики поверхностных опухолей продолжает
оставаться весьма актуальной задачей и является целью данной работы.
Одним из перспективных подходов для
решения этой задачи является использование длительно люминесцирующих соединений
и специальной техники регистрации сигнала фосфоресценции в режиме временного
разрешения. Фосфоресценцией при комнатной температуре обладают платиновые
комплексы порфиринов. Они имеют уникальные спектральные характеристики: высокие
значения молярных коэффициентов поглощения (ε) – порядка 10-5 М-1
см-1, значительный (>250 нм) сдвиг спектра испускания относительно
спектра возбуждения (Стоксов сдвиг) и высокие квантовые выходы люминесценции
(φ) при комнатной температуре [1].
В таблице приведены
спектрально-люминесцентные характеристики синтезированных нами платиновых
комплексов природных и синтетических порфиринов.
|
Соединение |
λmax, (ε·10-3 M-1cm-1),
CHCl3 |
λem, нм |
τ, мкс |
|
|
B-полоса, нм |
Q-полосы, нм |
|||
|
1. Pt КП III |
381 (285) |
501 (12.8), 561 (50) |
645 |
75 |
|
2. Pt УП |
381 (266) |
502.5 (13.7), 536.7 (53) |
646 |
78 |
|
3. Pt ДП IX |
379 (220) |
499 (13), 532.4 (36.5) |
642 |
86 |
|
4. Pt ОЭП |
382 (290) |
534 (62) |
647 |
75 |
|
5. Pt ТФП(F5)4 |
390 (322) |
503 (23), 537 (29) |
648 |
68 |
Для дальнейших исследований нами был
выбран Pt-комплекс копропорфирина III (Pt КП III) исходя из того, что это природный объект и его можно
получать экологически чистым микробиологическим путем [2]. Изучение токсичности
для данного соединения проводилось на мышах самцах линий BDF1 и Balb/c. Определены
тест-дозы Pt КП III: LD100 – 200 мг/кг
веса, LD50 – 120 мг/кг, МПД – 80 мг/кг веса [3].
В дальнейших исследованиях были изучены
собственная фосфоресценция (аутофосфоресценция) Pt КП III и
кинетика накопления в органах, тканях и привитых опухолях мыши (мышиная модель ex vivo) методами флуориметрии с временным разрешением. Платиновый
комплекс вводили как в свободном виде, так и в виде его конъюгатов с
α-фетопротеином (АФП), маркером гепатомы и моноклональными антителами ICO-1 к лимфоме Беркетта.
Для снижения влияния аутофосфоресценции на
результаты оценки распределения Pt КП III в органах и
тканях мышей мы использовали регистрацию сигнала фосфоресценции на двух длинах
волн (645 и 615 нм) при одной длине волны возбуждения (375 нм). Повышение
соотношения интенсивностей на 645 и 615 нм указывает на накопление Pt КП III и может быть зарегистрировано в присутствии
эндогенных соединений, формирующих фоновый уровень аутофосфоресценции органов и
тканей мышей (рис. 1). Использование высокочувствительной аппаратуры на основе
флуориметрии с временным разрешением (ГосНИИ БП) позволило надежно, с высоким
контрастом диагностировать наличие опухоли при внутривенном введении препарата
в концентрации 0.02 мг/кг живого веса, что более чем в 2000 раз ниже
максимально переносимой дозы (МПД) для этого препарата.
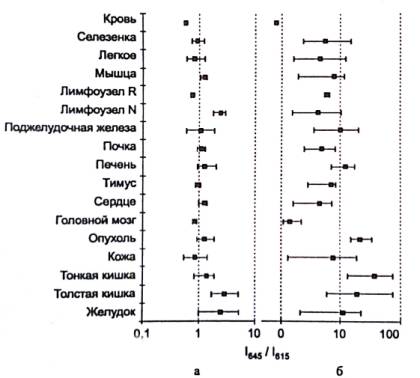
Рис. 1. Соотношение интенсивностей люминесценции на 645 и 615 нм различных органов и тканей мышей с саркомой 37: а – аутолюминесценция белых беспородных мышей (n = 5); б – наведенная Pt КП III люминесценция белых беспородных мышей (n = 3) и мышей линии BALB/c (n = 3) при времени экспозиции 2 часа
Как свободный Pt КП III, так и конъюгированный маркер активно накапливаются в
органах и тканях мыши. Для получения большего контраста было увеличено время
экспонирования для конъюгата АФП/Pt КП III, введенного
мышам DBF с перевивной гепатомой. За это время как свободный
маркер, так и конъюгат практически выводятся из всех органов и тканей, но
сохраняются в опухоли. В зависимости от размера и части исследованной
опухолевой ткани люминесцентный контраст между ней и нормальной тканью
составлял от 2 до 10 раз. При этом уровни сигнала в 10-50 раз превышали пороговые
уровни детектирования, необходимые для надежного определения фосфоресцентной
метки использованным оборудованием.
Полученные данные свидетельствуют о
перспективности использования Pt КП III и его
конъюгатов для ранней диагностики визуально и эндоскопически доступных опухолей
с использованием методологии регистрации люминесценции в режиме временного
разрешения, при котором уровень аутофосфоресценции многократно ниже, чем
уровень найденной фосфоресценции.
Литература:
1. Румянцева В.Д, Ивановская Н.П.,
Коноваленко Л.И., Цуканов С.В., Миронов А.Ф., Осин Н.С. // Биоорган. химия.
2008. Т. 34. № 2. С.262-268.
2. Быховский В.Я., Зайцева Н.И., Миронов
А.Ф., Осин Н.С., Печерских Е.В., Румянцева В.Д., Сухин Г.М. // Прикладная
биохимия и микробиология. 2001. Т. 37. № 6. С.660-668.
3.
Sukhin G.M., Rumyantseva V.D., Ivanov A.V., Ivanovskaya N.P., Mironov A.F.,
Osin N.S. // Photodiagnosis and Photodynamic Therapy. 2008. V.5. P. S26-S27.