Химия
и химические технологии/6. Органическая химия
Магистр х. Арутюнян А.С., д.х.н. Пароникян Е.Г, д.х.н. Норавян А.С.
Институт тонкой органической
химии ИТОХ
им. А. Л. Мнджояна НТЦ ОФХ НАН РА, Ереван,
Армения
E-mail: harutyunyan_arpi@mail.ru
Синтез новых производных трициклических тиено[2,3-b]пиридинов по реакции Торпа-Циглера
Многие синтетические производные пиридина
успешно используются в медицине и обладают антидепрессантной, противовоспалительной,
антибактериальной, противомикробной, антивирусной и противоопухолевой
активностью [1-5]. Это обстоятельство обусловило стремление синтезировать на
основе доступных исходных веществ производные замещенных тиено[2,3-b]пиридинов.
В качестве исходных соединений для
синтезов были использованы конденсированные с шестичленными циклами
4-цианпиридинтионы [6-8]. Взаимодействием последних с фенацилбромидами и
амидами хлоруксусной кислоты получены S-алкилпроизводные,
далее подвергнутые циклизации в щелочной среде с образованием 1-аминотиофенов.
В ИК-спектрах последних отсутствуют полосы поглощения CN группы и присутствуют характерные для NH2-
и NH-групп полосы поглощения в области 3160-3400 см-1.
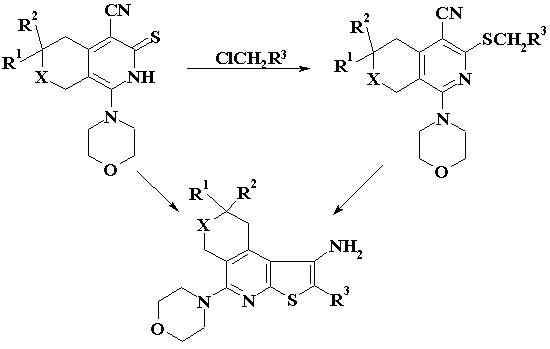
X=CH2, NMe, O; R1=H, Ме; R2=H, Ме, i-Pr; R3=Ar, COAr, CONR4R5, R4= R5=H,
Alk.
С целью синтеза конденсированных тиено[2,3-b]пиридинов, содержащих арильную группу во втором
положении тиофенового кольца, конденсированные 4-цианпиридинтионы введены во
взаимодействие с замещенными в кольце бензилхлоридами в присуствии
водно-спиртового раствора гидроксида калия. В результате алкилирования получены
арилметилтиопиридины, подвергнутые затем воздействию спиртового раствора
этилата натрия с образованием трициклических тиено[2,3-b]пиридинов. Исследования
показали, что на ход циклизации последних в значительной степени оказывают
влияние наличие и природа заместителей, а также их расположение в бензольном
кольце. Так, оказалось, п-нитропроизводные
получаются из пиридинтионов непосредственной реакцией исходных тетрагидроизохинолинов
с п-нитробензилхлоридом. Оказалось,
что при наличии в бензольном кольце алкилирующего агента двух атомов хлора в
различных положениях циклизация имеет место лишь в присуствии пятикратного
избытка этилата натрия, а при наличии атома хлора в орто- или пара- положениях
или при отсутствии заместителей циклизация происходит только в первом случае.
Об образовании трициклов свидетельствует наличие в спектрах ЯМР 1H уширенного синглета протонов аминогруппы тиофенового
кольца при 3.54-5.04 м.д. и отсутствие в
ИК-спектрах полосы поглощения нитрильной группы.
Литература:
1.
Ning-Yu Wang, Wei-Qiong Zuo, Ying Xu, Chao Gao, Xiu-Xiu Zeng, Li-Dan Zhang, Xin-Yu You, Cui-Ting Peng, Yang Shen, Sheng-Yong Yang, Yu-Quan Wei, Luo-Ting Yu// Bioorg. & Med. Chem. Let., 2014, V. 24, Is. 6, p.
1581–1588.
2.
Huan Liu, Yi Li, Xiao-Hua Wu Huan Liu, Yi Li, Xiang-Ying Wang, Bo Wang, Hai-Yun He, Ji-Yan Liu, Ming-Li Xiang, Jun He, Xiao-Hua Wu, Li Yang// Bioorg. & Med. Chem. Let., 2013, v. 23, Is. 8, p. 2349–2352.
3.
Euphemia Leung, Joy M. Hung, David Barker and J´ohannes
Reynisson// Med. Chem. Commun., 2014,
v. 5, p. 99–106. Homayon J. Arabshahi, Euphemia Leung, David Barker and
J´ohannes Reynisson // Med. Chem. Commun., 2014, v. 5, p. 186–191.
4.
E. A. Bakhite, A. E. Abdel-Rahman, O. S. Mohamed, and E. A. Thabet// Bull. Korean Chem. Soc. 2002, Vol. 23,
No. 12, p. 1709-1714.
5.
Пароникян Е.Г., Мирзоян Г.В., Норавян А.С., Авакимян Д.А., Тер-Захарян Ю.З.// Хим.-фарм.ж., 1993, №11, с. 29.
6. Пароникян Е.Г., Норавян А.С.// ХГС, 1999, №7, с. 914.
7. Gewald K.,
Hentschel M., Illigen U. // J. prakt.
chem., 1974, v. 316, p. 1030.