Химия и химические
технологии/6. Органическая химия
Магистр х. Дашян Ш. Ш., д.х.н.
Пароникян Е. Г., д.х.н.
Норавян А. С.
Научно-технологический центр органической и фармацевтической химии
НАН Республики Армения, Институт тонкой органической химии
им. А. Л. Мнджояна.
Синтез новых
конденсированных гетероциклов - пиридо[4',3':4,5]тиено[3,2-d]-9,11-оксазинов и
пиридо[4',3':4,5]тиено[3,2-d]пиримидинов
Производные
тиено[3,2-d]пиримидинов представляют интерес в качестве биологически активных
соединений [1,2].
Схема 1
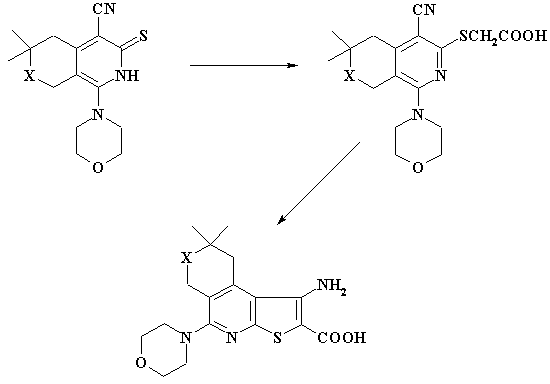
X = O, S, N-CH3.
В продолжение
исследований по поиску биологически активных соединений
в ряду конденсированных
гетероциклов нами разработаны методы синтеза
тиено[3,2-d]пиримидинов
конденсированных с производными пирано(тиопирано)[3,4-с]пиридинов и
2,7-нафтиридинов.
Схема 2
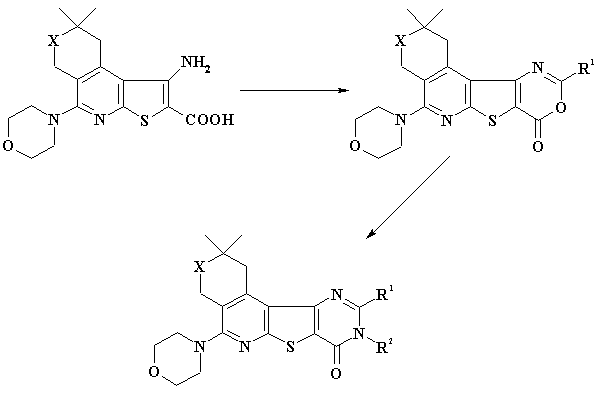
X = O, S, N-CH3; R1 =
Alk; R2 = NH2, Alk.
Взаимодействием
4-цианпиридинтионов [3] с бромуксусной кислотой в присутствии
гидроксида калия получены S-алкилзамещенные производные,
циклизацией которых в этанольном растворе этилата натрия синтезированы конденсированные
3-амино-2-карбокситиено[2,3-b]пиридины (схема 1). В ИК спектрах последних
отсутствуют полосы поглощения, характерные для CN группы и появляются полосы
поглощения NH2 группы в области 3140-3490см-1. В спектрах
ЯМР 1H сигналы аминогрупп проявляются при 6.3-6.5 м.д.
Взаимодействием
3-амино-2-карбокситиено[2,3-b]пиридинов с уксусным или пропионовым ангидридом
получены тиено[3,2-d]-9,11-оксазины, в которых эндоциклический атом кислорода
при взаимодействии с гидразином и аминами легко заменяется на атома азота. В
результате выделены тиено[3,2-d]пиримидины (схема 2). В
тиено[3,2-d]-9,11-оксазинах полосы поглощения CO группы выходят в области 1740-1750 см-1,
а у конденсированных тиено[3,2-d]пиримидинов – 1670-1680 см-1.
ЛИТЕРАТУРА
1.
A. Agarwal,
Sh. Louise-May. J. A. Thanassi, S. D. Podos. J. Cheng. Ch. Thoma, C. Liu, J. A. Wiles, D. M. Nelson, A. S. Phadke.
B. J. Bradbury, M. S. Deshpande, M. J. Pucci. // Bioorg. And Med. Chem. Letters 2007, 17, p.
2807-2810.
2. J. Taltawull, J.
Serrat, J. Gracia, A. Gevada, M. Andres, M. Cordoba, m. Miralpeix, D. Vilella,
J. Beleta, H. Ryder, L. Pages. // J. Med. Chem., 2010, 53, p. 6912-6922.
3. Пароникян Е. Г., Мирзоян Г. В., Норавян А. С., Авакимян Д. А., Tер-Захарян Ю. З. // Хим.-фарм. ж., 1993, т. 27, №11, с. 29.