Санжаков М.А., Ипатова О.М., Медведева Н.В.,
Дружиловская О.С., Захарова Т.С., Тихонова Е.Г., Игнатов Д. В., Торховская Т.И.
Федеральное государственное бюджетное учреждение
“Научно-исследовательский институт биомедицинской химии
имени В.Н. Ореховича",
Москва,
Рифампицин, включённый в фосфолипидные наночастицы: изменение
фармакокинетических свойств при
внутривенном введении
Рифампицин – макроциклический
полусинтетический антибиотик, производное
природного рифамицина SV – наиболее распространённый препарат современной противотуберкулёзной
терапии. Его широкое использование обусловлено возросшей в
последнее десятилетие заболеваемостью туберкулёзом. Механизм действия рифампицина заключается в
блокировании ДНК-зависимой РНК-полимеразы в клетках возбудителя туберкулёза, Mycobacterium tuberculosis. Недостатком этого препарата являются
его побочные действия, в
частности, гепатотоксичность и гриппо-подобный синдром. В системном кровотоке
основная доля рифампицина связывается с
белками плазмы крови, что снижает количество свободного лекарства и,
следовательно, его эффективность. Это, наряду с быстрым выведением лекарства,
вынуждает прибегать к высоким дозам, повышая тем самым и побочные действия. Их
проявление усугубляется необходимостью длительной терапии, более полугода.
Поэтому, наряду с поиском новых
противотуберкулёзных препаратов, проводятся разработки новых композиций
рифампицина с использованием систем
доставки, которые позволили бы добиться максимального эффекта при более
низких дозировках.
Нами была разработана транспортная система из фосфолипидных
наночастиц с размером менее 30 нм с
включением рифампицина, на основе
соевого фосфатидилхолина более 96 % чистоты
(Липоид S-100),
с добавлением олеата натрия. Система
представляет собой водную эмульсию наночастиц, устойчивую при хранении в
форме лиофилизированного порошка. В экспериментах in vitro она показала более выраженное ингибирование роста клеток M.tuberculosis, чем те же дозы свободного рифампицина, а
после 6 недель перорального введения мышам, инфицированным штаммом M.tuberculosis Erdman, в
лёгких наблюдалось более чем 20-кратное снижение числа колоние-образующих
единиц (КОЕ) по сравнению с действием свободного лекарства. В экспериментах in vitro было
показано также перераспределение
рифампицина от белковой фракции плазмы
к липопротеинам, с преимущественной ассоциацией с липопротеинами низкой
плотности (ЛНП) (Sanzhakov et al., 2014). Целью настоящей работы было проследить за
изменением уровня лекарства в плазме крови и тканях крысы при внутривенном введении .
Препараты
рифампицина – свободный и в составе
фосфолипидных наночастиц - вводили
животным внутривенно в дозе 10 мг/кг.
Через 30 минут животных
забивали, образцы тканей и плазмы крови
экстрагировали метанолом, и в
экстрактах определяли уровень рифампицина методом
LC/MS на
хроматографе Agilent 1200 Series (“Agilent
Technologies”, США) с масс-спектрометрическим детектором 6130 Quadrupole LC/MS, с ионизацией
электрораспылением.
Через 30 минут после
введения наблюдалось большее (на 62%) количество рифампицина в ткани лёгких животных, получивших
рифампицин в наночастицах, по сравнению с инъекциями свободного лекарства,
наряду с небольшим (на 15%) повышением его уровня в печени (рис. 1).
В этот временной период наблюдалось также
большее количество рифампицина в плазме
после введения в
составе наночастиц, чем
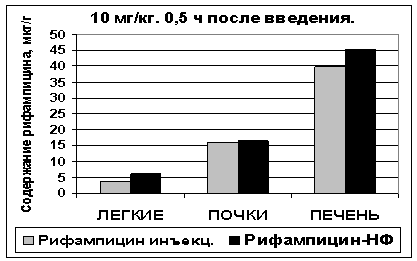
Рис. 1. Содержание рифампицина в тканях
крысы через 30 минут после инъекционного
введения (НФ – нанофосфолипидные частицы).
после введением свободного лекарства.
Через 24 часа показано отсутствие лекарства в плазме, для обоих способов
введения (рис 2) .
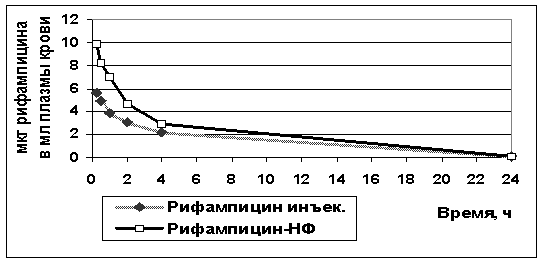
Рис. 2. Содержание рифампицина в плазме крови
Наблюдаемое
повышение поступление рифампицина в ткань лёгких при включении в
фосфолипидные наночастицы (рис. 1) может быть следствием как его большей
концентрации в плазме крови, так и показанного нами ранее перераспределения
рифампицина к ЛНП, способствующего
доставке в альвеолярные макрофаги. Это должно способствовать повышению
его противотуберкулёзного действия.