Медицинские науки/8.Морфология
К.б.н Григоренко Д.Е., акад. РАМН, проф. Сапин М.Р.
ФГБУ
НИИ морфологии человека РАМН Москва, Россия
Перестройка структурных зон селезенки мышей при
моделировании космического полета
Введение. При длительных космических экспедициях к числу
наиболее значимых воздействий на
организм человека остается невесомость, которая приводит к развитию гипокинезии
в связи с ограничением движений [2,3,5].
В современных медико-биологических исследованиях, связанных с изучением
влияния факторов космического полета на организм космонавта, широкое распространение
получили наземные модельные эксперименты. При изучении невесомости у космонавтов и при экспериментальных
исследованиях установлены четкие изменения гомеостаза и биоэнергетики в тканях
организма [6,7]. Отмечаются структурные изменения в миокарде, в органах
дыхательной, выделительной, костно-мышечной и сосудистой систем [2,4,6,]. Для изучения влияния невесомости
на организм млекопитающих на
биоспутнике «БИОН-М1» был проведен эксперимент с целью исследования физиологического
состояния мышей и функционального
состояния некоторых органов и тканей [1,4]. Несмотря на многочисленные
биохимические и физиологические
исследования, менее всего изучены
морфологические изменения
органов иммуногенеза у животного организма в условиях космического
полета. Известно, что именно состояние иммунной системы характеризует и
обеспечивает стабильное функционирование организма при воздействии различных
внешних факторов [8,9] и дает возможность изучения сопротивляемости организма в
экстремальных ситуациях, а также разработки
новых профилактических мероприятий,
направленных на нормализацию функции иммунной системы [3,5,6]. Вместе с тем в литературе имеется не достаточно
сведений о реакции органов иммунной системы и их морфофункциональном состоянии
в условиях невесомости. Исходя из этого, целью нашего исследования являлось
изучение реакции иммунной (лимфоидной) ткани селезенки у мышей линии С57/bl6 при моделировании
30-суточного космического полета.
Материал
и метод. В качестве объекта
исследований были выбраны мыши самцы линии С57/bl6 в возрасте 19-20 недель. Изучены 2 группы животных. Первая группа - виварный контроль, в котором мыши находились
в стандартных условиях вивария (6 особей). Вторая группа - наземный эксперимент, в котором мыши
находились в течении 30 суток (8 мышей), где воспроизводились аналогичные
условия содержания и среды обитания на биоспутнике. Животных содержали в блоках "БИОС-МЛЖ", использованных
в полетном эксперименте. Блоки содержания животных были установлены в климатической
камере, в которой температура, влажность и газовый состав атмосферы
соответствовали в полете биоспутника. Освещенность в блоках осуществлялась при
12-часовом световом дне (включение
света происходило в 9,00 час). Животные
виварной группы и наземного эксперимента получали стандартный гранулированный комбикорм
и воду в свободном доступе. После окончания экспериментов животные были забиты методом цервикальной дислокации. Эксперименты выполнялись в соответствии с
Европейской конвенцией о защите позвоночных животных, используемых для
экспериментов или в иных научных целях (Страсбург, 18 марта 1986) и приказом
№742 Министерства высшего и среднего специального образования СССР "Об
утверждении Правил проведения с использованием экспериментальных животных"
от 13.11.1984.
Селезенки мышей фиксировали в 10% растворе нейтрального
формалина, заливали в парафин. Гистологические срезы, толщиной 4-5 мкм,
окрашивали азур2-эозином, гематоксилином-эозином и по ван Гизон. В селезенке
исследовали цитоархитектонику центров размножения лимфоидных узелков, являющихся
зоной созревания В-лимфоцитов и
характеризующих состояние гуморального иммунитета, а также клеточный
состав периартериальных лимфоидных муфт
(ПАЛМ) - морфологической зоны
созревания и накопления Т-лимфоцитов, определяющих состояние клеточного
иммунитета в селезенке мышей. Изучен
качественный и количественный клеточный состав лимфоидных структур
селезенки на единице площади
гистологического среза (в
880мкм²). Подсчет всех клеток в лимфоидных зонах селезенки проводили под микроскопом (Leica) при увеличении объектива – х100, под масляной
иммерсией. Использовали 25-узловую
морфометрическую сетку с шагом 10 мкм, вмонтированную в окуляр
(10х) микроскопа. Статистическая
обработка абсолютного и относительного (в %) числа клеток в
структурных зонах органа результатов проведена по программе «Statistika 6.0» и Excel. Значимыми
считали различия при р≤0,05.
Результаты
исследования. У интактных
мышей (виварный контроль) средние весовые показатели массы тела составляют 29,10 г. В
селезенке лимфоидные образования представлены , в основном, лимфоидными узелками без центра
размножения, лимфоидные узелки с центрами размножения- немногочисленны. В этих
лимфоидных узелках центры размножения
небольшие, расположены ассиметрично, т.е. сдвинуты к периферии узелка.
Плотность распределения клеток в центрах
размножения лимфоидных узелков составляет 45,07±4,18 клетки на единице площади
гистологического среза. Основную долю всех клеток в центрах размножения
составляют средние лимфоциты (25,27±1,93%). Малодифференцированные клетки
представлены бластами и большими лимфоцитами, на долю которых приходится 12,98%
(2,82%-бласты и 10,16%-большие лимфоциты). Выявлены клетки с картинами митозов
(0,93±032%), зрелые (антителпродуцирующие)
плазматические клетки (2,04±0,42%) и незрелые плазматические клетки
(плазмобласты -0,97±0,43%). Малых лимфоцитов в 1,8 раз меньше, чем средних
лимфоцитов. В центрах размножения лимфоидных узелков в равном количестве
выявлены ретикулярные и деструктивно измененные клетки (19,99% и 18,75%-
различия не достоверны). Содержание макрофагов, составляющих 4,98%, в 3,7 раза,
чем деструктивных клеток.
В селезенке мышей в группе виварного контроля периартериальные
лимфоидные муфты (ПАЛМ) широкие, четко дифференцируются. Плотность распределения
клеток в них составляет 56,73±3,08 клетки на стандартной площади среза, среди
которых преобладают лимфоциты
(61,0%), представленные на 46,37±2,77% малыми и на 14,63±1,61% средними лимфоцитами.
Стромальные ретикулярные клетки
составляют 17,35% и несколько меньше выявлено деструктивно измененных
клеток – 13,67%. В ПАЛМ выявлено 2,82% малодифференцированных клеток (0,11% -
бластов и 2,71% - больших лимфоцитов). Клетки с картинами митозов не
выявлены.
Среди плазматических клеток более всего выявлено зрелых
(антителпродуцирующих) плазмоцитов
(1,68%) и меньше - плазмобластов (0,58%). Макрофаги составляют 2,90±0,50%.
После наземного эксперимента масса мышей
составляет 28,4 г., при этом отмечается резкое уплотнение клеточной структуры в
центрах размножения лимфоидных узелков: плотность клеток увеличивается на 27,6
клеток (до 72,67 клеток). При этом выявлено снижение числа клеток с картинами
митозов в 1,8 раза (до 0,50%) и достоверно уменьшается содержание зрелых
антителпродуцирующих плазматических клеток в 2,3 раза (до 0,88%, Рис.1).
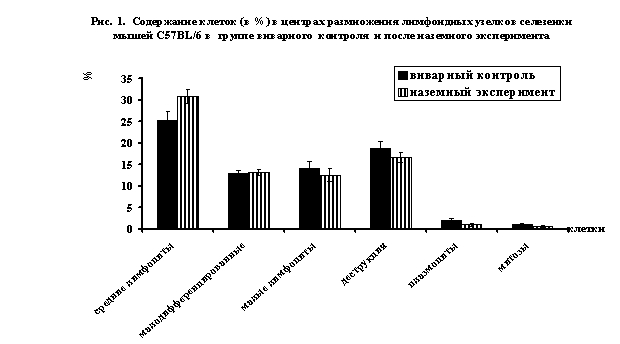
После наземного эксперимента достоверно не
изменяется количество малодифференцированных клеток, деструктивно измененных
клеток, макрофагов и ретикулярных клеток.
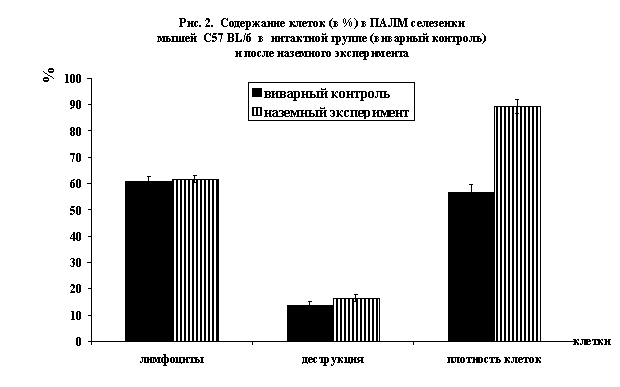
После наземного эксперимента в ПАЛМ
селезенки мышей происходят более выраженные изменения, чем в центрах
размножения лимфоидных узелков. Плотность распределения клеток также
увеличивается на 32,54 клетки (до 89,27±2,64 клетки, рис.2).
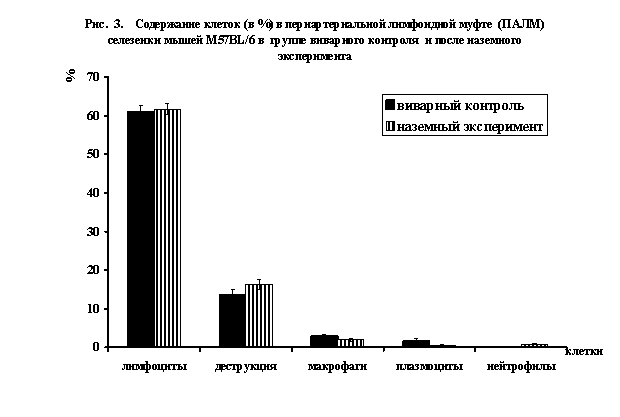
В ПАЛМ (рис. 3) исчезают бласты, количество
плазмоцитов (антителпродуцирующих)
клеток уменьшается в 3,0 раза (до 0,55±0,22%) и макрофагов в 1,5 раза
(до 1,92±0,34%). Появляются зрелые и
незрелые формы нейтрофилов (0,77%), достоверно усиливается деструкция клеток в
1,2 раза.
Заключение. Таким
образом, установлено, что в селезенке мышей периартериальные лимфоидные муфты (ПАЛМ) являются своеобразной
зоной-мишенью, которые наиболее активно реагирует в условиях наземного
эксперимента. В ПАЛМ выявлено усиление
деструктивных процессов наряду с снижением утилизирующей функции клеток, о чем
свидетельствует уменьшение содержания макрофагов [9]. Выявленное увеличение числа нейтрофилов свидетельствует о
проявлении аллергической реакции [9,12].
Отмеченное подавление бласттрансформации клеток приводит к исчезновению бластов
и снижению активности созревания
антителпродуцирующих клеток в ПАЛМ. Комплекс
изменений в цитоархитектонике ПАЛМ селезенки после наземного
эксперимента свидетельствуют о снижении
функциональной активности Т-зависимой
морфологической зоны, регулирующей клеточный иммунитет [8].
В центрах размножения лимфоидных узелков селезенки мышей, в отличии от ПАЛМ, после наземного эксперимента
четко выражено сохранение функциональной активности. Выявленная перестройка в клеточном составе центров размножения
касается только некоторого снижения активности лимфоцитопоэза, что подтверждается сохранением
клеток с картинами митозов на фоне равного содержания
малодифференцированных клеток, и в уменьшении числа антителпродуцирующих
плазматических клеток [8,10,11]. Полученные результаты характеризуют высокую
функциональную активность центров размножения лимфоидных узелков, морфологической
зоны созревания В-лимфоцитов, ответственных за формирование гуморального
иммунитета [8,10].
Литература.
1. Андреев-Андриевский А.А., Шенкман Б.С.,
Попова А.С., Долгов О.Н.. и др.
Экспериментальные исследования на мышах по программе полета биоспутника
«БИОН-М1». Авиакосмическая и экологическая медицина. 2014, т. 48, №1, с. 14-27.
2. Володина А.В.
Влияние невесомости на ультраструктуру микрососудов скелетых мышц. В сб. 2-го
Российск. конгресса по патофизиол. с междунар. участием «Патофизиология органов
и систем. Типовые патологические процессы». М., 2000, РГМУ, с. 334.
3. Газенко О.Г.
Предвидение в рождении научных идей. В сб. мат. 2-го Российск. конгресса по
патофизиол. с междунар. участием «Патофизиология органов и систем. Типовые
патологические процессы». М., РГМУ 2000, с.334-335.
4. Григорьев А.И., Ильин Е.А. Животные в
космосе. Вест. Рос. академии наук. М., 2007, т. 77, №11, с.
963-973.
5. Коваленко
Е.А. О проблеме гипокинезии в современной медицине. В сб. 2-го Российск.
конгресса по патофизиол.с междунар. участием «Патофизиология органов и систем.
Типовые патологические процессы». М., РГМУ, 2000, с.335.
6. Константинова
И.В. Система иммунитета в экстремальных условиях. Проблемы космической биологии.
М., Наука. 1989., Т. 59, 288 с.
7. Ларина И.М Космический полет и регуляция метаболизма у человека. М., Наука,
2004, с. 13-16.
8. Сапин М.Р., Никитюк Д.Б. Иммунная система,
стресс и иммунодефицит. М., АПП «Джангар», 2000, 184 с.
9. Серов В.В.. Шехтер Б.А. Соединительная
ткань (функциональная морфология и общая патология). М., Медицина. 1981, 312 с.
10.Gray D. Understanding germinal centre. Res. Immunol., 1991, v. 142, p.
236-242.
11.Vaček A., Bueverova E., Michurina T. Decrease
in The number of progenitors of fibroblasts in bone marrow of rats after a
14-day flight onboard the Cosmos-2044 Biosatellite. Folia Biologica, 1990, V.
36, p. 194 – 197.
12. Vaček
A., Michurina T., Serova L.V. Decrease
in The number of progenitors of erythrocytes, granulocytes and macrophages in
bone marrow of rats after a 14-day flight onboard the Cosmos-2044 Biosatellite.
Folia Biologica, 1991, V. 37, p. 35 –
41.