Мотроненко В.В.
Національний технічний
університет України «КПІ»
Аналіз
впливу перемішування на культивування міцеліальних грибів
Використання глибинного культивування мікроорганізмів в об'ємі рідини
широко використовується в біотехнологічній промисловості, і зокрема при
культивуванні міцеліальних грибів (базидіоміцетів) [1].
Як показує аналіз літературних джерел [1-14], вплив перемішування на
мікроорганізми в процесі глибинного культивування відіграє важливу роль. Для
забезпечення максимального виходу кінцевої продукції необхідно підібрати режим
перемішування таким чином, щоб до клітин мікроорганізмів надходили, в
необхідній кількості, поживні речовини і кисень при збереженні їх високої
життєздатність.
Особливо гостро дане питання постає при глибинному культивуванні
міцеліальних грибів, так як підібрати оптимальний режим для їх культивування
дуже складно враховуючи їх морфологічну будову, а саме розгалуженість міцелію. Метод глибинного
культивування має
ряд переваг в порівнянні з поверхневим вирощуванням. Механічне перемішування і
безперервна аерація створюють сприятливі умови для доступу поживних речовин і
кисню до всіх клітин міцелію, забезпечуючи однаково сприятливі умови для росту
і накопичення продуктів метаболізму [1].
Проведений нами огляд
літератури виявив, що інтенсивність перемішування суттєво впливає на ріст та здатність накопичувати біомасу
міцеліальних грибів. В залежності від морфологічних властивостей грибів даний
показник змінюється від 50 до 900 об/хв. (дивись таблицю 1)
[3-14]. Всередньому
при глибинному культивуванні міцеліальних грибів частота обертання перемішуючих
пристроїв складає 120-180 об/хв.
Таблиця 1. Характеристика режиму перемішування
в залежності від виду продуценту, що
використовується [3, 4, 6-14]
|
№ п/п
|
Продуцент
|
Число
обертів
мішалки, об/хв
|
|
1
|
Asp. Awamori - 460
|
48-300
|
|
2
|
Fusarium sambucinum
|
600-900
|
|
3
|
Ganoderma lucidum
|
50
|
|
4
|
Beauveria bassiana
|
180
|
|
5
|
Eremothecium ashbyi Guilliermond F340
|
150
|
|
6
|
Laetiporus
sulphureus та Polyporus
|
120-150
|
|
7
|
Schirophyllum commune
|
180-190
|
|
8
|
Grifola frondosa
|
60-70
|
|
9
|
Laetiporus sulphureus
|
120
|
|
10
|
Trichoderma virens BKMF-1117
|
200
|
|
11
|
Chlorella vulgaris C-1
|
180
|
 Наприклад для дослідження інтенсивності
перемішування на ріст Fusarium sambucinum [4]
використовували апарати BioFlo 110 (виробленівироблені США)
об’ємом 1,3 л з двоярусною турбінною мішалкою відкритого типу
діаметром 55 мм. Із графіку зображеного на рисунку 1, ми бачимо, що найбільш
інтенсивно накопичення біотами відбувається при 700 об/хв., що відповіда
лінійній швидкості перемішування 2 м/с. Подальше збільшення швидкості обертання
призводить до зничення активності накопичування біомаси та активного
спороутворення [4].
Наприклад для дослідження інтенсивності
перемішування на ріст Fusarium sambucinum [4]
використовували апарати BioFlo 110 (виробленівироблені США)
об’ємом 1,3 л з двоярусною турбінною мішалкою відкритого типу
діаметром 55 мм. Із графіку зображеного на рисунку 1, ми бачимо, що найбільш
інтенсивно накопичення біотами відбувається при 700 об/хв., що відповіда
лінійній швидкості перемішування 2 м/с. Подальше збільшення швидкості обертання
призводить до зничення активності накопичування біомаси та активного
спороутворення [4].
Рисунок 1 – Вплив інтенсивності
перемішування на ріст Fusarium sambucinum
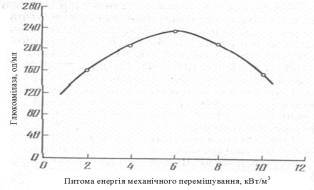
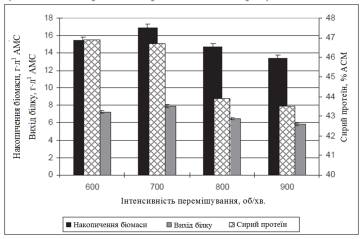
В статті [3] наводяться результати досліджень залежності біосинтезу культурою Aspergillus awamori ферменту
глюкоамілази. Досліди проводили в промислових умовах використовуючи паралельно
два ферментери об’ємом 5 м3 кожен, обладнаних одноярусними
турбінними мішалками діаметром 600 мм (діаметр апарату – 2000 мм) барботером і
4 відбійними перегородками. Кількість обертів валу мішалки
змінювалася від 48 до 300 об/хв. Як видно з графіку (рисунок 2) максимальний вихід
ферменту спостерігається при питомій механічній енергії 6 кВт/м3. Подальше збільшення інтенсивності перемішування призводить до
зниження синтезу внаслідок механічного пошкодження міцелію гриба. Також, було
встановлено, що при інтенсивності перемішування менше 2 кВт/м3
міцелій гриба не отримував необхідної кількості кисню для інтенсивного накопичення
біомаси і синтезу ферментів [3].
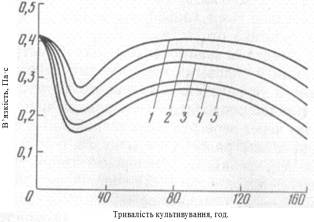
Також було встановлено, що інтенсивність
перемішування впливає на зміну в’язкості культуральної рідини, очевидно,
впливаючи, в першу чергу, на структуру міцелію, тобто на його морфологічні
характеристики, що ми можемо бачити з гафіку представленого на рисунку 3, Виявлено,
що в’язкість зменшується через 30-80 годин від початку ферментації. Саме на цей період припадає утворення дуже розгалужених гіф міцелію – чим
менша інтенсивність перемішування – тим більше утворюється таких колоній. При
збільшенні інтенсивності перемішування збільшується в’язкість і спостерігається
тенденція до утворення укорочених гіф. Також,
з графіку ми можемо бачити, що із збільшенням питомої механічної
енергії, що затрачується на перемішування – в'язкість зростає в меншій мірі [3].
В [5] наводиться
порівняння умов росту і дослідження морфологічних властивостей Laetiporus sulphureus (сірчано-жовтий
труповик) в залежності від способу культивування, поверхневе культивування проводили на сусловому
агарі впродовж 7діб, глибинне – в біореакторах з механічним перемішуванням або
без нього та аерацією. Мікроскопічні
досліди показали, що міцелій в поверхеій культурі складається з довгих
септичних гіф з простими розгалуженнями без утворення міцеліальних пряжок (рисунок 4а) [5].
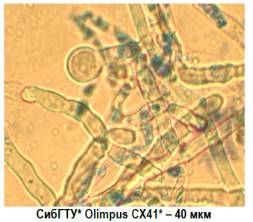
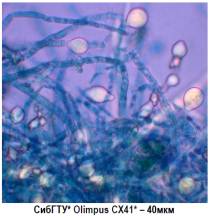
а) поверхнева
культура б) глибинна культура
Рисунок 4 – Оптична
мікрофотографія грибів Laetiporus sulphureus
В глибинних умовах міцелій здатний
утворювати товстостінні хламідоспори (рисунок 4б), в культуральній рідині
присутні різноманітні морфологічні структури – колонії з плоским центром і
периферичним міцелієм, шаро- та грушподібні утворення, ниткоподібні фрагменти. При
глибинному культивуванні відбувається більш швидке накопичення біомаси [5]. При
глибинному культивуванні і відсутності механічного перемішування (рисунок 5а, 5б)
утворюються чітко фрагментовані окремо розміщені структури із розгалуженим
краєм за рахунок периферичних міцеліальних утворень [5].
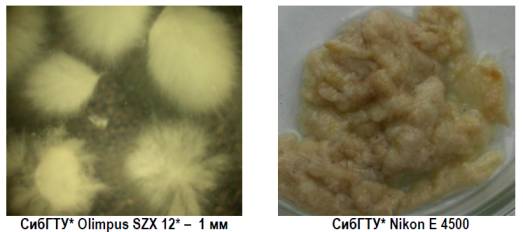
Рисунок 5 – Оптична
мікрофотографія грибів Laetiporus sulphureus без механічного перемішування
В умовах глибинного культивування і механічного
перемішування (рисунок 6а, 6б) міцелій фрагментується на відносно невеликі
сегменти, які не втрачають здатність до розмноження і накопичення біомаси,
також, на растровому мікроскопі видно, що відбувається значне накопичення
спорового матеріалу. З чого можна зробити
висновок, що таких способом доцільно вирощувати посівний матеріал для подальшої
ферментації [3].

а)
збільшення в 500 раз б) збільшення в 5000 раз
Рисунок
6 – Оптична мікрофотографія грибів Laetiporus sulphureus
з
механічним перемішуванням
Висновки: З усього сказаного вище
видно, що при культивуванні міцеліальних грибів важливу роль відіграє
інтенсивність механічного перемішування, при цьому, залежності від продуценту,
що використовується, кількість обертів змінюється від 50 до 700 об/хв. В середньому кількість обертів мішалки лежить
в межах 120-180 об/хв. Але в наведених роботах, не вивчено механізм дії перемішуючих
пристроїв на здатність росту клітин мікроорганізмів, що викликає необхідність
подальшого вивчення цього питання.
Література
1.
А.С.
Бхало Высшие съедобные
базидиомицеты в чистой культуре // Институт ботаники им. Н.И. Холодного. –
Киев: Наукова думка. – 1988. – 144 с.
2.
Костик,
С.І. Математичне моделювання гідродинаміки перемішуючого пристрою з магнітним
приводом [Текст] / С. І. Костик, Л. І. Ружинська, В. Ю. Шибецький, О. О. Ревтов
// ScienceRise. – 2016. - №4/2(21). – C. 27-31.
3.
Б.А. Устинников
Оптимизация перемешивания культуральной жидкости при глубинном культивировании
миктрорганизмов [Текст] / Б.А. Устинников, В.В. Иванов, Г.П. Георгиевский М.Г. Каукин //
Ферментная и спиртовая промышленность. – 1987. – № 5. – С 54-58.
4.
Неманова
Е.О. Выбор режимных параметров при глубинном
культивировании продуцента микропротеина [Текст] / Неманова Е.О., Русинова
Т.В., Горшина Е.С., Бірювов В.В. // Известия МГТУ «МАМИ». – 2013. – № 1(15), т.4. – С. 271-277.
5.
О.В.
Киселева Морфологические
особенности базидиального гриба Laetiporus sulphureus в поверхностной и
глубинной культуре [Текст] / О.В. Киселева, П.М. Миронов, Ю.А. Литовка // Вести КрасГАУ. –
2012. – № 1. – С.91-95.
6.
М.И. Леонтьева Условия
аэрации как фактор регуляции биосинтеза эндополисахаридов и образования пеллет
погруженной культуре Ganoderma lucidum [Текст] / М.И. Леонтьева,
А.В. Барков, А.В. Автономов, Л.К. Краснопольская, А.А. Новиков // Башкирский
химический журнал. – 2010. – № 3, т. 17. – С. 136-140.
7.
В.Ю. Секова Глубинное
культивирование энтомопатогенного гриба Beauveria
bassiana [Текст] / В.Ю. Секова, Н.А. Корнилова, А.В.
Васильева // Успехи в химии и химической технологии. – 2010. – № 11 (116), т. XXIV. – С. 42-45.
8.
В.Ю. Поліщук Динаміка росту і накопичення
рибофлавіну аскоміцетом Eremothecium ashbyi
Guillier [Текст] / В.Ю. Поліщук, М.І.
Маланюк, О.М. Дуган // Наукві вісті НТУУ «КПІ». – 2014. – № 3. – С. 73-77.
9.
Л.П. Дзигун Вплив умов
культивування на ріст ксилотрофних базидіоміцетів Polyporus
squamosus (HUDS.)
FR. та Laetiporus sulphureus (BULL.: FR.)
murrill [Текст] / Л.П. Дзигун, О.М. Дуган // Вісник аграрної науки Причорномор’я. – 2012. –
№ 1. – С. 178-185.
10.
А.С.
Бухало Ферментна активність вищого базидіального гриба Schirophyllum
commune [Текст] / А.С. Бухало, О.М.
Дуган, М.Р. Максимюк, В.М. Ліновицька // Вісник НАУ. – 2012. – № 3. – С.
154-159.
11.
В.М.
Ліновицька Підбір умов глибинного культивування Grifola frondosa як основи для створення біотехнології отримання
лікувально-профілактичних препаратів [Текст] /
В.М. Ліновицька, А.С. Бухало, О.М. Дуган // Наукові вісті НТУУ «КПІ». – 2011.
– № 3. – С. 56-60.
12.
Л.П.
Дзигун Культивування дереворйнівного гриба Laetiporus sulphureus (BULL.: FR.) murrill
(basidioycota) на рідких поживних середовищах [Текст] / Л.П. Дзигун // Український ботанічний
журнал. – 2008. – № 1, т. 65. – С.
124-132.
13.
И.В.
Стручкова Микроскопические грибы Trichoderma virens – перспективне продуценты в микоризных сообществах [Текст] / И.В. Стручкова // Вестник
Нижегородского университета им. Н.И. Лобачевского. – 2014. – № 3 (3). – С.
114-118.
14.
Ф.Т.
Мамедова Получние метана в процессе биотрансформации биомассы иммобилизованных
клеток мицелиального гриба Rhizopus oryzae, использованных для получения молочной кислоты [Текст] / Ф.Т.
Мамедова, О.В. Сенько, О.В. Маслова, Т.А. Махлисс, Е.Н. Ефременко //
Вестник биологии. – 2015. – № 1, т.11. – С. 28-32.
 Наприклад для дослідження інтенсивності
перемішування на ріст Fusarium sambucinum [4]
використовували апарати BioFlo 110 (виробленівироблені США)
об’ємом 1,3 л з двоярусною турбінною мішалкою відкритого типу
діаметром 55 мм. Із графіку зображеного на рисунку 1, ми бачимо, що найбільш
інтенсивно накопичення біотами відбувається при 700 об/хв., що відповіда
лінійній швидкості перемішування 2 м/с. Подальше збільшення швидкості обертання
призводить до зничення активності накопичування біомаси та активного
спороутворення [4].
Наприклад для дослідження інтенсивності
перемішування на ріст Fusarium sambucinum [4]
використовували апарати BioFlo 110 (виробленівироблені США)
об’ємом 1,3 л з двоярусною турбінною мішалкою відкритого типу
діаметром 55 мм. Із графіку зображеного на рисунку 1, ми бачимо, що найбільш
інтенсивно накопичення біотами відбувається при 700 об/хв., що відповіда
лінійній швидкості перемішування 2 м/с. Подальше збільшення швидкості обертання
призводить до зничення активності накопичування біомаси та активного
спороутворення [4].