Панасенко О. І., Парченко В. В., Кремзер О. А., Самура Т. О., Мельник І. В., Гоцуля А.
С., Саліонов В.О., Сафонов А.А., Щербина Р. О., Буряк
В. П., Куліш С. М., Постол Н. О., Панасенко Т. В.
Запорізький державний медичний університет, Україна
УФ-СПЕКТРОФОТОМЕТРІЯ ПОХІДНИХ КУМАРИНУ
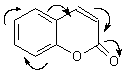
Молекула кумарину
(бензо-α-пірону) є складовою частиною кількостей сполук, які проявляють
різнобічні фармакологічні властивості.
Вони знаходять широке застосування при лікуванні різних захворювань ( 4 ) і тому цілком зрозуміла
зацікавленість, яку виявляють
дослідники до вивчення фізико-хімічних властивостей зазначеної групи речовин.
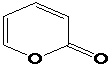
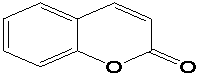
α–пірон (1,2-пірон) кумарин
(1,2-бензопірон)
π–Електронна
система α–пірона складається з 8
рухливих електронів : 4–π– електрона кратних С
= С зв`язків, неподілена пара
гетероатома кисню та π– електрона
групи С
= О. У зв`язку із тим, що із 7
молекулярних орбіталей α– пірона чотири є зв`язуючими, а три –
розпушуючими, то всі вісім рухливих електронів α–пірона можуть бути
розміщені на зв`язуючих орбіталях, що спричиняє утворення стійкої замкненої
оболонки, тобто такої оболонки, у якій усі зв`язуючі орбіталі заповнені, а
розпушуючі – вільні (5). У молекулах кумарину та фуро кумарину дванадцять
рухливих електронів знаходяться на шести зв`язуючих орбіталях і тому також
утворюють стійку оболонку, а неподілена пара електронів гетероциклічного атома
кисню і π–електрона С=О-групи утворюють єдину циклічну супряжену систему,
сполук які досліджуються. У праці Berson (9) досліджені УФ спектри похідних
піронів і піридонів. Автор зазначає, що азотвміщуючі гетероцикли володіють
поглинанням при більших довжинах хвиль, ніж їх аналоги, що містять гетероатом
кисню. Відзначено, що α – сполуки мають смугу поглинання в більш
довгохвильовій частині спектру, ніж γ–похідні, але з меншою інтенсивністю.
Крім того, зазначено, що бензопохідні мають дві смуги поглинання, а моно
циклічні сполуки – ні.
Cingolani та співавтори (11, 12,
16) досліджували спектри поглинання кумарину та його
оксі- та метальних похідних у розчинниках кислого, нейтрального и лужного
характера. На підставі проведених досліджень було зроблено висновок що
характери спектрів зазначених речовин у кислоті і лугу погоджується із
можливістю існування кумаринів у лактонній формі і у вигляді о- оксикоричної
кислоти, а смугу поглинання кумарину, 3-метил- і 4-метилкумарину в етанолі
характеризуються високоінтенсивною смугою з максимумами в межах 265 – 275нм і
низько інтенсивною – при 325 – 375 нм.
Спектри
деяких похідних кумаринів вивчалися також Goodwin, Pollok (13), Mattoo (15),
Shan, Bafna (17), які у своїх оглядах обговорили власні дослідження, а також данні
наукової лутератури з метою вивчення можливості застосування електронних
спектрів поглинання для різних похідних ізомерних кумаринів і зробили наступні
висновки :
Алкільні
субстітуєнти, що введені до ядра кумарину, виявляють незначний вплив на смугу
поглинання сполуки, яка досліджується. Тільки у випадку, коли алкільні
угрупування виявляють просторовий вплив субстітуєнти із неподіленою парою
електронів, які приймають участь у супряженні (ОH, O, AlK,Сl, Br, NO2, NH2),
спостерігається помітна зміна характера УФ-спектрів сполук, що в значній мірі
залежить від положення субстітуєнта та його електронодонорних та електроноакцепторних
властивостей, а збільшення кількості резонансних структур приводить до
батохромного або гіперхромного зсуву у спектрі поглинання.
Однак на підставі
одержаних даних, інтерпретація яких базувалася на теорії резонансу, неможливо
пояснити низку факторів, які при цьому спостерігаються. Так, в спектрі
6–оксікумарину спостерігається смуга з максимумами при 343 нм.
Згідно теорії резонансу зсув довгохвильової смуги поглинання до червоного
регіону є можливим лише у тих випадках, коли для сполуки можливо написати
додаткову кількість резонансних структур. Для 6– оксікумарину цього зробити
неможливо, і в той же час його довгохвильова смуга знаходиться у більш
червоному регіоні та тільки у порівнянні із кумарином, але й у порівнянні із
7–оксікумарином, для якого можливо надати додаткову біполярну структуру. Matteo (15) припустив, що 6-оксікумарин існує у наступних таутомерних формах:
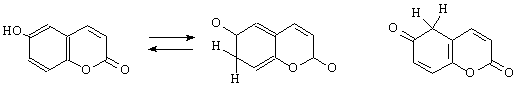
Деякі автори
зазначають (11,
17), що введенна до 5 – 7 та 8– положення оксі- та метоксігруп спричиняє гіпсохромний зсув
довгохвильової смуги. Однак М. Е. Терельсон та Ю. Н. Щейнкер (6, 7), які
використовували метод в приближенні Тарізера-Тарпа-Тапла та Хоккеля, доказали,
що довгохвильова смуга у 5- та 8-оксікумарина проявляє низку інтенсивність, але
зсунута до червоного регіону і маскується інфлексією більш інтенсивної смуги
поглинання ,яка знаходиться у середній частині спектру. Аналогічна картина
характерна і для 5- та 8-оксікумаринів. В спектрі оксикумаринів в інтервалі 220 –370
нм Chatterjee, Сhandhury (10) виявили по дві або по три смуги поглинання. Нижче 220 нм
проявляється ще одна інтенсивна смуга
поглинання. У 4-метно-6-оксікумарина короткохвильова смуга зсунута до 227 нм. В
інтервалі 225 – 262 нм більшість оксикумаринів мають мінімум, який відрізняє їх
від оксіхромонів, характерний мінімум яких знаходиться при 280 нм. В деяких
своїх наукових працях Cingolani (11, 12) вивчили спектри кумаринів 0,1 м
розчині натрію гідроксиду. Зміна характера смуги дослідник пов'язував із розкриттям
лактамного кільця із утворенням солей оксі– транскоричної кислоти. М. Е. Терельсон та співавтори (2) вивчили питання про таутомерно
4-оксікумарину та його похідних, для яких було запропонована
рівновага наступного типу:
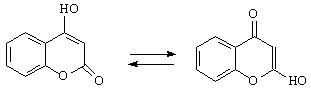
На підставі вивчення
даних за інтегральними інтенсивностями карбонільних деяких піронів і хромонів
автори прийшли до висновку, що однакові величини інтенсивності карбонільних
смуг у 4оксікумаринах та 4– метоксікумаринах виключають наявність у розчинах
4–оксікумарину хромонової структури. Ф. Е. Каган, Т. А. Когет (3) вивчили
УФ-спектри кумарина, 4-оксікумарина, зоокумарина, його натрієвої солі,
дикумарина, та неодикумарина в етанолі, хлоророформі і розчинах натрію
гідроксиду. Авторами встановлено, що в етанолі і хлороформі 4-оксікумаририн,
фепромарон і зоокумарин мають три максимума,а дикумарин і неодикумарин - два
максимуми. У лужному середовищі усі досліджуванні сполуки мають тільки одну
смугу поглинання у довгохвильовій частині спектру.
Дослідження УФ спектрів серії заміщено
кумаринів(ди-, три- та тетразаміщені сполуки, субстітуєнти ОН, МеСОО, МеО,
СООН, Вu, NO2, а також деякі монозаміщенні) присвячена наукова
стаття Masrani та співавторів(14). Авторами встановлено, що
в УФ спектрі кумарину присутні дві смуги: при 311 нм
(перехід в угрупуванні  піронового циклу) та 274 нм (бензольне поглинання). Розглянуто вплив субстітуєнтів на спектральні
характеристики зазначених переходів електронів. Введення +М субстітуєнтів до
бензольного циклу (положення 5, 7 і 8) викликає
багатохромний зсув другої смуги, особливо сильному для 7
положення. Введення будь-якого субстітуєнта в положення 6 викликає
багатохромний зсув другої смуги і не впливає на першу смугу. Якщо субстітуєнт
відтягує електрони від групи С=О (–М або –І ефект), то спостерігається
багатохромний зсув першої смуги, а якщо він проявляє донорні властивості (+М
або +І), спостерігається гіпсохромний зсув. При введенні субстітуєнтів в
положення 4 та 5 спостерігаються стеричні ефекти - об'ємні субстітуєнти викликають гіпсохромний зсув другої смуги.
піронового циклу) та 274 нм (бензольне поглинання). Розглянуто вплив субстітуєнтів на спектральні
характеристики зазначених переходів електронів. Введення +М субстітуєнтів до
бензольного циклу (положення 5, 7 і 8) викликає
багатохромний зсув другої смуги, особливо сильному для 7
положення. Введення будь-якого субстітуєнта в положення 6 викликає
багатохромний зсув другої смуги і не впливає на першу смугу. Якщо субстітуєнт
відтягує електрони від групи С=О (–М або –І ефект), то спостерігається
багатохромний зсув першої смуги, а якщо він проявляє донорні властивості (+М
або +І), спостерігається гіпсохромний зсув. При введенні субстітуєнтів в
положення 4 та 5 спостерігаються стеричні ефекти - об'ємні субстітуєнти викликають гіпсохромний зсув другої смуги.
Однак слід
зазначити,
що УФ спектр кумарину в етанолі характеризується
інтенсивними максимумами при 274 нм та 310 нм(1) як зазначається в науковій праці(14) перший максимум авторами був
віднесений до бензольного поглинання, а другий максимум-до
переходу електронів в угрупуванні  піронового цикла. Перший максимум дійсно характеризується
як L b-смуга і відповідає π-π-переходу електронів бензольного
циклу.Однак із віднесення другого максимума,до переходу електронів в
угрупуванні
піронового цикла. Перший максимум дійсно характеризується
як L b-смуга і відповідає π-π-переходу електронів бензольного
циклу.Однак із віднесення другого максимума,до переходу електронів в
угрупуванні  неможливо погодитися, так як згідно
даним Л.
Фізер та М. Фізер (8)
радо початковий хромофор єнона Н2С – СР
– С = О має максимум поглинання у короткохвильовій частині спектру,а сам при 215 нм. Таким чином максимум при 310 нм може бути обумовлений
тільки р-π-супряженням бензольного цикла із зазначеним єтаном:
неможливо погодитися, так як згідно
даним Л.
Фізер та М. Фізер (8)
радо початковий хромофор єнона Н2С – СР
– С = О має максимум поглинання у короткохвильовій частині спектру,а сам при 215 нм. Таким чином максимум при 310 нм може бути обумовлений
тільки р-π-супряженням бензольного цикла із зазначеним єтаном:
Можливо,що до ланцюга супряження
долучається також гетероатом кисню із вільною парою електронів. Введення окси-групи в положення 4 молекули
кумарину спричиняє розщеплення максимума при 274 нм
на два максимума при 269 та 280 нм та гіпсохромному зсуву
другого максимума на 6 нм. До того-ж, на спектрі 4–оксікумарину спостерігається
інфлексія при ≈ 315 нм.
Висновки
1. Існують різні погляди на тонку хімічну структуру та природу смуг поглинання
електронних спектрів кумарину та деяких його похідних:
а) не ідентифікована
довгохвильова смуга поглинання в електронних спектрах сполук похідних кумарину,
а також немає пояснення явищу багатохромного та гіпсохромного зсуву
довгохвильової смуги у спектрах 5-, 6–,7– і 8– заміщенних оксікумаринів;
б) немає однаковості
погляду на природу окремих смуг поглинання моно- та полізаміщенних сполук
кумарину.
в) відсутні данні по
визначенню основних оптичних характеристик УФ спектрів кумарину та його
похідних,
що не дає можливості виявити біологічно активну частину
їх молекули
(фармакофор).
2. Немає достовірних даних по визначенню вірогідності та дозволеності
переходів електронів у смугах поглинання кумарину та його похідних.
Література
1. Буряк В. Н. Исследования и разработка
способов оценки качества лекарственных средств, содержащий (какой то там)
кислород // Дис. Докт. Фарм. Наук. - Запорожье, – 1989. – 271с.
2. Интегральные интенсивности карбонильных
полного ряда пиронов и хинонов, М. Е. Перельсон, Ю. Н. Шейнкер, Б. Е. Зайцев,
В. А. Поздыщев // изд. АН СССР. Сер. хим. – 1964. – №5. – С.
804 – 808.
3. Машковский М.Д. Лекарственные
средства: узд.перераб.,испр.и доп.-М.:ООО // Издательство Новая
Волна, 2000г. В 2-х т. т. 1. –
540р., Т.2 – 668р. – 14-е.
4. О качественной оценке устойчивости гетероциклических систем в палках приближеннях Токкеля (Д. А.
Бочвар, Н. Т. Тамборян, И. В. Станкевич, А. Л. Чистяков // Журн. Физ. химии. – 1958. – т. 32, вып. 12. – C. 2797 – 2802.
5.
Bergson I. A. A qualitative correlation
of the spectra of Sanoe heterocyclic carbonyl compounds // I.Amler.chem.Soc.
1953 / – Vol. 75, № 14. – C. 3521 – 3523.
6.
Cingolani E.Ricerche Sui benzopironi spettri U.V.di 3- e 4- metilcumarine //
Gazz.chim.ital. – 1954 – Vol. 84, № 9. – P. 825
– 842.
7. Cingolani E. Analisi
spettrofotometrica delle cumarine // Ann.
Chim. (Ronta).-1953 / – Vol. 47, № 5. – P. 557 – 574.
8.
Shiavello A., Cingolani E. Ricerche sui benzopironi sintesi e proprieta di
lacuna 4-fornoilcumarine // Gazz.chim. Itul. – 1951. – Vol. 81, № 819. – P.
717 – 724.