Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Пономарёв А.И.,
*Косьянов Д.Ю., *Бондарев Н.В., **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Влияние состава смешанных растворителей
вода-диоксан, вода-ацетон и ионной ассоциации на выход коронатов
(18-краун-6)NaCl и (18-краун-6)КCl
Цель работы:
количественная оценка равновесного выхода коронатов натрия (18С6NaCl) и
калия (18С6KCl) в водно-апротонных (вода-диоксан,
вода-ацетон) растворителях.
Задачи исследования: сформировать базу данных о
средних ионных коэффициентах активности электролитов NaCl, 18С6NaCl и KCl,
18С6KCl в растворителях вода-диоксан, вода-ацетон на основе
полуэмпирического интерполяционного уравнения Стокса и Робинсона; методом
итераций оценить концентрационные константы устойчивости краун-эфирных
комплексов хлоридов натрия и калия в водно-апротонных растворителях; оценить
влияние первичных эффектов водно-органических растворителей, первичных солевых
эффектов и равновесных концентраций реагентов на выход коронатов натрия и калия в водно-органических
растворителях; оценить константы ассоциации контактных ионных пар М+
+ Сl- = M+Cl- в водно-апротонных растворителях с диэлектрической
проницаемостью < 46,7 по модели Айгена-Денисона-Рамзи-Фуосса (АДРФ: сфера в
непрерывном диэлектрике); оценить влияние ионной ассоциации на выход продуктов комплексообразования – коронатов
натрия и калия.
Равновесный выход короната (LMCl)
определялся по мольной доле комплекса в равновесном растворе
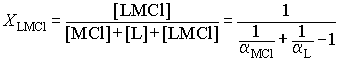
Расчеты степени комплексообразования
реагентов проведены методом итераций для
интервалов концентрации солей от 0.1 до 2.1 моль/(кг растворителя) и
краун-эфира – от 0.1 до 0.7 моль/(кг растворителя).
Равновесный выход хлорида короната
калия (рис. 1) и натрия возрастает с ростом начальной концентрации реагентов и
достигает максимума при начальных концентрациях соли и лиганда mоMCl = mоL
= 0.5 моль/(кг растворителя) в водно-диоксановом растворителе с ХDO =
0.235.
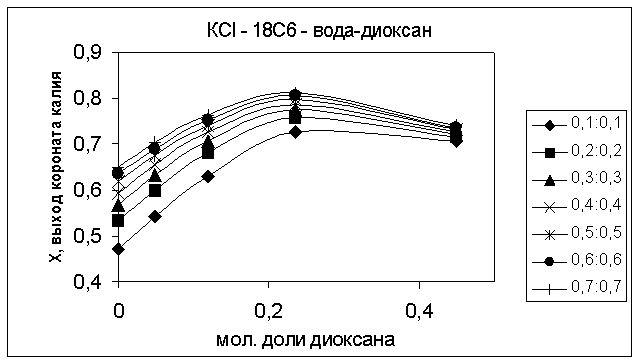 Рис. 1. Выход короната калия в растворителях вода-диоксан
Рис. 1. Выход короната калия в растворителях вода-диоксан
На рис. 2 показано влияние первичных эффектов
водно-диоксановых растворителей ![]() , солевых эффектов
, солевых эффектов ![]() и эффектов равновесных концентраций
и эффектов равновесных концентраций
![]() на изменение равновесного
выхода короната калия в растворителях вода-диоксан
на изменение равновесного
выхода короната калия в растворителях вода-диоксан
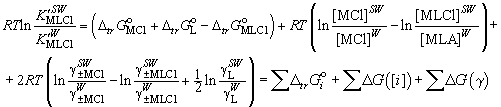
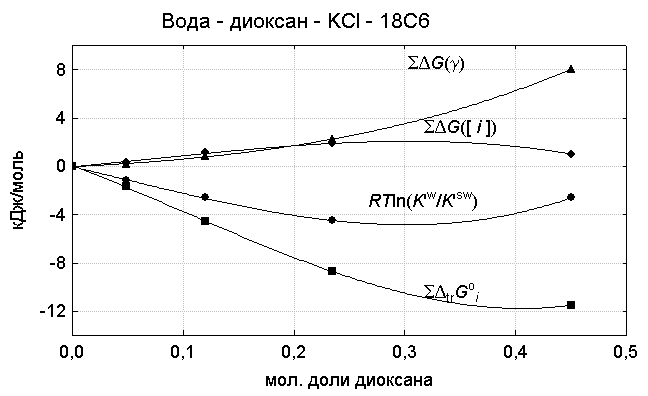 Рис. 2.
Влияние эффектов среды на выход короната калия
Рис. 2.
Влияние эффектов среды на выход короната калия
Ионная ассоциация как конкурирующее равновесие, приводит к образованию
ионной пары M+ + Сl- = M+Cl– в водно-апротонных растворителях. С учетом
равновесия ионной ассоциации получено уравнение для оценки выхода продукта
реакции в предположении, что концентрация несвязанной формы катиона металла [M+]
пренебрежимо мала
![]()
где ![]() ; x = KLMCl/(KLMCl – Kass);
у =
; x = KLMCl/(KLMCl – Kass);
у = ![]() +
+ ![]() .
.
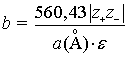
![]() Согласно модели АДРФ
Согласно модели АДРФ
Показано, что учет ионной ассоциации в смешанных
водно-органических растворителях приводит к понижению выхода коронатов на
≈ 20%.