Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Белевцова Т.В.,
*Бондарев Н.В., **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Моделирование
Гальвани-потенциала границы раздела фаз водный раствор / мицеллярный раствор
ионогенных ПАВ при распределении уксусной кислоты
Целью работы является разработка
электрохимической модели образования двойного электрического слоя по
адсорбционно-нейтрализационному механизму в растворах ионогенных ПАВ [1].
Объект исследования: кислотно-основные равновесия уксусной кислоты в
растворах ионогенных ПАВ.
Показана
возможность использования водно-этиленгликолевых растворителей как моделей
стандартного состояния для ионов и молекул уксусной кислоты в мицеллах ионогенных
ПАВ, оценен Гальвани-потенциал границы раздела мицеллярная фаза/водный раствор,
который экспериментально измерить невозможно.
Полученные
результаты могут быть положены в основу разработки практических
рекомендаций по управлению критической концентрацией мицеллообразования в растворах
ионогенных ПАВ посредством слабых электролитов.
Влияние первичных эффектов среды (DtrGo(H+), DtrGo(A-)), коэффициентов активности (DG(γ*A-), DG(γ*H+)) и равновесных концентраций ионов (DG([A-]), DG([H+])) и молекул DG([HA]) уксусной кислоты
на энергию Гиббса образования ДЭС (DGэл(H+), DGэл(A-)) в растворах ионогенных ПАВ передается соотношениями [1]:
DGэл(H+) = –FDφ = –F(φm – φw) = DtrGo(H+) + DG([HA]) – DG([A-]) – DG(γ*A-)
DGэл(A-) = FDφ
= F(φm – φw) = DtrGo(A-) + DG([HA]) – DG([H+]) – DG(γ*H+)
Из
анализа рисунка следует, что термодинамическому
критерию самопроизвольного образования ДЭС ![]() по адсорбционно-нейтрализационному
механизму отвечают константы распределения кислоты меньше 0.1.
по адсорбционно-нейтрализационному
механизму отвечают константы распределения кислоты меньше 0.1.
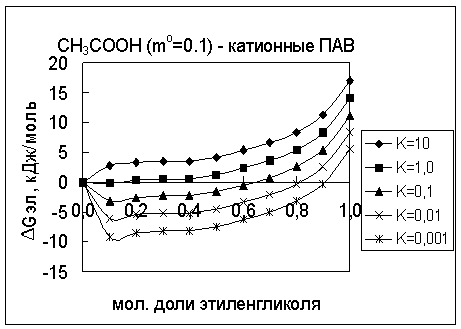
Рисунок. Зависимость DGэл
от варьируемого коэффициента распределения уксусной кислоты между водным
раствором и мицеллами катионных ПАВ
Приведенная
ниже таблица иллюстрирует применение модельного подхода к оценке влияния
различных факторов на формирование двойного электрического слоя (величину
Гальвани-потенциал) границы раздела
водный раствор / модельная псевдофаза катионных ПАВ, на примере протолитических
равновесий распределения и диссоциации уксусной кислоты. Известно, что в области
Штерна, где локализованы не слишком гидрофобные частицы электролита, значение
эффективной диэлектрической проницаемости для мицелл катионных ПАВ, в частности
алкиламмониевого типа, ниже 40. В пользу этого предположения свидетельствует анализ значений
сольватохромных параметров Димрота-Райхардта (ЕТ(30) и ЕТN)
и Камлета-Тафта (p*), проведенный в [2]. В тоже время для мицелл анионных ПАВ
характерна некоторая "водоподобность" [2]. Так, диэлектрическая проницаемость анионных ПАВ типа сульфатов
или сульфонатов выше 40. Таким образом, можно предположить, что образованию ДЭС
по адсорбционно-нейтрализационному механизму в растворах ионогенных ПАВ
отвечает идентичность стандартного состояния ионов и молекул уксусной кислоты в
мицеллярной фазе и в водно-этиленгликолевых растворителях: вода-этиленгликоль
(0.6-0.7 мол.д. ЭГ) – для мицелл катионных ПАВ (рисунок) и вода-этиленгликоль
(0.5-0,6 мол.д. ЭГ) – для мицелл анионных ПАВ.
Таблица.
Значения модельного гальвани-потенциала ∆mw φ межфазной
границы водный раствор/мицеллярная фаза анионного ПАВ для коэффициента
распределения уксусной кислоты К=0.01 и исходной концентрации m0HAc =0.1 моль/(кг растворителя)
|
К |
m0HAc |
XЭГ |
pK(m) |
αHAc |
X0HAc |
[H+] |
[HAc] |
|
0.01 |
0.1 |
0 |
4.756 |
0.0132 |
0.00178 |
2.35E-05 |
0.001757 |
|
|
m0,wHAc |
0.1 |
5.033 |
0.0922 |
2.22E-05 |
2.05E-06 |
2.02E-05 |
|
|
0.09901 |
0.2 |
5.350 |
0.0649 |
2.66E-05 |
1.72E-06 |
2.48E-05 |
|
|
m0,mHAc |
0.3 |
5.609 |
0.0486 |
3.09E-05 |
1.5E-06 |
2.94E-05 |
|
|
0.00099 |
0.4 |
5.850 |
0.0371 |
3.53E-05 |
1.31E-06 |
3.4E-05 |
|
|
|
0.5 |
6.121 |
0.0273 |
3.96E-05 |
1.08E-06 |
3.86E-05 |
|
|
|
0.6 |
6.412 |
0.0196 |
4.4E-05 |
8.62E-07 |
4.31E-05 |
|
|
|
0.7 |
6.670 |
0.0146 |
4.84E-05 |
7.06E-07 |
4.77E-05 |
|
|
|
0.8 |
6.888 |
0.0114 |
5.27E-05 |
5.99E-07 |
5.21E-05 |
|
|
|
0.9 |
7.272 |
0.0073 |
5.71E-05 |
4.18E-07 |
5.67E-05 |
|
|
|
1 |
8.477 |
0.0018 |
6.15E-05 |
1.13E-07 |
6.13E-05 |
|
I |
lgγ*H+ |
∆mw φ, В |
∆G([HAc]) |
∆G([H+]) |
∆G(γ*H+) |
∆trGAc- |
∆Gэл.Ac- |
|
0.001309 |
-6.1E-05 |
0.0 |
0.00 |
0.00 |
0 |
0.00 |
0.00 |
|
9.13E-05 |
-1.9E-07 |
0.03273 |
-11.08 |
-6.06 |
0.000347 |
1.86 |
3.16 |
|
6.43E-05 |
-2E-07 |
0.00680 |
-10.56 |
-6.48 |
0.000346 |
3.42 |
0.66 |
|
4.82E-05 |
-2E-07 |
-0.01576 |
-10.14 |
-6.82 |
0.000346 |
4.84 |
-1.52 |
|
3.67E-05 |
-2E-07 |
-0.03862 |
-9.78 |
-7.17 |
0.000346 |
6.34 |
-3.73 |
|
2.7E-05 |
-2E-07 |
-0.05729 |
-9.47 |
-7.64 |
0.000346 |
7.36 |
-5.53 |
|
1.94E-05 |
-1.9E-07 |
-0.07262 |
-9.19 |
-8.20 |
0.000347 |
8.00 |
-7.01 |
|
1.44E-05 |
-1.8E-07 |
-0.08307 |
-8.94 |
-8.70 |
0.000347 |
8.26 |
-8.01 |
|
1.12E-05 |
-1.7E-07 |
-0.08266 |
-8.72 |
-9.10 |
0.000347 |
7.60 |
-7.98 |
|
7.25E-06 |
-1.5E-07 |
-0.09255 |
-8.51 |
-9.99 |
0.000347 |
7.45 |
-8.93 |
|
1.81E-06 |
-8.3E-08 |
-0.17544 |
-8.32 |
-13.24 |
0.000347 |
12.00 |
-16.93 |
1. Bondarev
N.V. Thermodynamics of chemical equilibria. Methodological and practical
aspects // Book of abstracts International conference "Modern Physical
Chemistry for advanced materials (MPS’07) ", devoted to the 100th anniversary
of the birth of professor Nikolai Izmailov. Kharkiv, Ukraine. –2007.
– P.169-171.
2.
Мчедлов-Петросян Н.О. Дифференцирование силы органических кислот в
истинных и организованных растворах. Х.:
ХНУ, 2004. 326 с.