Писаненко Д.А., Климко Ю.Е.
Национальный технический университет Украины
«Киевский политехнический институт»
Синтез 4-(1-арилциклоалкил)бензойных кислот и их эфиров
Известно, что
введение циклопентильного радикала в структуру ряда соединений таких, как,
например, фосфонистые кислоты [1], N-пиперазиноацил- и N-пиперазиноалкиланилины
[2], галоидфеноксиуксусные кислоты [3] усиливает их фармакологические свойства
и биологическую активность, проявляющуюся в воздействии на микрорганизмы.
Циклопентилзамещенные бензойные кислоты используют также, как составляющие
фирменных препаратов для фармакологии [4]. Учитывая вышеуказанный эффект от
введения циклопентильного радикала в структуру исследованных веществ и
представления об облегчении образования связей за счет вандер-ваальсова
взаимодействия циклов с субстратом [5], можно предположить, что не меньший
интерес могут представить соединения, в структуре которых будет присутствовать замещенный циклоалкильный радикал.
Например, 4-(1-арилциклоалкил)бензойные кислоты, для синтеза которых могут быть
использованы 1-(4-бромфенил)-1-арилциклоалканы, простой метод получения которых
был разработан ранее [6], и известные превращения, представленные на схеме:
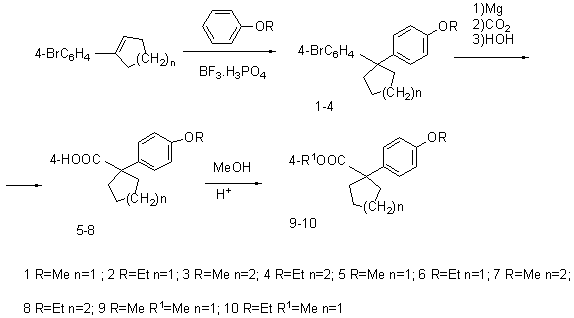
Необходимые исходные бромсодержащие
1,1-диарилциклоалканы были получены с выходами 40-62% арилциклоалкилированием
анизола и фенетола 1-(4-бромфенил)циклоалкенами, синтез которых осуществляли по
известной методике [7]. Реакцию арилалкилирования в присутствии катализатора BF3•H3PO4 проводили в среде CCl4 при молярных отношениях
арена, 1-арилциклоалкена и катализатора равных 5:1:0,3, температуре 70˚С и
времени реакции 7ч. Индивидуальность 1-(4-бромфенил)-1-(4-алкоксифенил)-циклоалканов
(1-4) была подтверждена ГЖХ-анализом на приборе Цвет-4 (10% апиезона L на
хромосорбе W, газ носитель – гелий), строение доказано с помощью
ПМР-спектрометрии (TESLA BS-487, внутренний стандарт
ГМДС)[6].
1-(4-Карбоксифенил)-1-(4-алкоксифенил)циклоалканы (5-8).
К 0,05 моль Mg в 5
мл ТГФ при перемешивании прибавляли раствор 0,05 моль 1-арилциклоалкена (1-4) в
25 мл ТГФ. Смесь выдерживали при кипячении и интенсивном перемешивании до
полного растворения магния, затем охлаждали до -5˚С и постепенно
небольшими порциями вводили в реактор 7-8г сухого льда. После окончания реакции
раствор обрабатывали разбавленной (1:1) соляной кислотой, органический слой
отделяли, сушили сульфатом магния, тетрагидрофуран отгоняли, а остаток,
представляющий собой соответствующий
1-(4-карбоксифенил)-1-(4-алкоксифенил)циклоалкан (5-8) перекристаллизовывали из
водног этанола. Константы полученных кислот приведены в таблице. ИК-спектры
соединений (5-8) содержат интенсивную полосу поглощения при 1675-1680 см-1
(-СООН)-прибор UR-10(таблетки с KBr).
Таблица
Константы синтезированных соединений (5-10)
|
Соединение |
n |
R |
R1 |
Т.пл.,˚С |
Выход,% |
|
5 |
1 |
Me |
H |
162 |
74 |
|
6 |
1 |
Et |
H |
153 |
72 |
|
7 |
2 |
Me |
H |
147 |
76 |
|
8 |
2 |
Et |
H |
159 |
75 |
|
9 |
1 |
Me |
Me |
50 |
71 |
|
10 |
1 |
Et |
Me |
42 |
74 |
Метиловые эфиры
(9-10) получали кипячением в течение 4ч
0,05 моль кислот (5-8) в 10 мл абсолютного метанола в присутствии 0,2 мл
конц.H2SO4.
После окончания реакции
смесь обрабатывали обычным способом, метанол отгоняли, а остаток
перекристаллизовывали из н-гексана. Выходы и константы эфиров (9-10) приведены
в таблице, в ИК-спектрах этих соединений присутствуют интенсивные полосы
поглощения при 1700-1705см-1 характерные для сложноэфирных
фрагментов –COOR.
Литература
1.
Салихадзе
Л.У., Магдеева Р.К./Тез.докл.науч.конф. «Синтез и исследование
биолог.актив.соед-ний». Рига, 1989,с.42.
2.
Пат.ЧССР
250580. N-Пиперазиноацил- и N-пиперазиноалкил-4-циклопентиланилины
и их соли. Опубл.15.07.1988, РЖХим.,1989,3О91П.
3.
Писаненко
Д.А., Палий Г.К., Крючкова В.Г.//Хим.-фарм.журн., т.44, №8,2010, с.22-24.
4.
Пат.США
2001003444А1. New compounds, their preparation and use. Опубл.25.10.2001.
5.
Теддер
Дж., Нехватал А., Джубб А. Промышленная органическая химия: пер. с англ. Под
ред. О.В.Коршунского. М.:Мир, 1977, 700с.
6.
Завгородний
С.В., Козликовский Я.Б., Писаненко Д.А.//Журн.орган.химии, т.8, вып.5, 1972,
с.1027-1030.
7.
Шабаров
Ю.С., Чурикова Т.П., Левина Р.Я.//Вестник МГУ, №1,1971, с.101.