Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Цыба Ю.В., *Бондарев
Н.В., **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Регрессионно-корреляционный
и термодинамический
анализ влияния свойств
растворителей вода-метанол,
вода-этанол,
вода-пропан-2-ол на силу уксусной
кислоты
Цель работы –
поиск адекватных моделей для описания наблюдаемых закономерностей в изменении
силы уксусной кислот от состава смешанных водно-органических растворителей.
Корреляционно-регрессионный анализ состоял из таких
основных этапов:
предварительная обработка и формирование базы данных; построение
корреляционной матрицы; выбор вида уравнений регрессии, оценка его значимости
по критерию Фишера (проверка нулевой
гипотезы); вычисление коэффициентов уравнения регрессии, оценка их значимости
по критерию Стьюдента; проверка адекватности построенной модели результатам
наблюдений на основе анализа остатков; применение принципа ЛСЭ для нахождения
связи между энергией Гиббса диссоциации кислот
и эффектами водно-органических растворителей.
В табл. 1 в качестве примера приведены энергии Гиббса
диссоциации уксусной кислоты в аквамоляльной концентрационной шкале и свойства
водно-метанольных растворителей.
Табл. 2 позволяет сделать
обоснованное заключение о коллинеарности дескрипторов: донорно-акцепторные (ETN – нормализованный параметр Димрота-Райхардта, BKT
– нормализованный параметр Камлета-Тафта), диэлектрические (1/eN, eN –
нормализованная диэлектрическая проницаемость) свойства и нормализованная плотность энергии когезии d2N водно-метанольных растворителей.
Факторные признаки (дескрипторы) для
построения моделей взаимосвязи отбирались шаговой регрессией (шаговым
регрессионным анализом).
Таблица 1. Энергии Гиббса диссоциации
уксусной кислоты в зависимости от свойств
водно-метанольных растворителей при 298,15 К
|
n=9 |
DrGod(HAc) кДж/моль |
1/eN |
ETN |
BKT |
d2N |
|
мол. доля спирта |
Вода – метанол – СH3COOH |
||||
|
0 |
27,15 |
1,000 |
1 |
0,19 |
1,00 |
|
0,1 |
28,47 |
1,094 |
0,92 |
0,26 |
0,94 |
|
0,2 |
29,86 |
1,195 |
0,88 |
0,36 |
0,88 |
|
0,3 |
31,05 |
1,304 |
0,84 |
0,43 |
0,81 |
|
0,4 |
32,28 |
1,421 |
0,82 |
0,50 |
0,75 |
|
0,5 |
33,78 |
1,546 |
0,81 |
0,53 |
0,69 |
|
0,6 |
35,52 |
1,679 |
0,80 |
0,54 |
0,63 |
|
0,7 |
37,36 |
1,822 |
0,79 |
0,55 |
0,57 |
|
0,8 |
39,48 |
1,975 |
0,78 |
0,54 |
0,51 |
Таблица 2. Корреляционная матрица
|
n=22 |
1/eN |
ETN |
BKT |
d2N |
DrGod(HAc) |
|
1/eN |
1,0000 |
-0,8744 |
0,8778 |
-0,6597 |
0,9335 |
|
ETN |
-0,8744 |
1,0000 |
-0,9774 |
0,5789 |
-0,8438 |
|
BKT |
0,8778 |
-0,9774 |
1,0000 |
-0,7082 |
0,9008 |
|
d2N |
-0,6597 |
0,5789 |
-0,7082 |
1,0000 |
-0,8635 |
|
DrGod(HAc) |
0,9335 |
-0,8438 |
0,9008 |
-0,8635 |
1,0000 |
Регрессионная модель зависимости DrGod(HAc) от свойств водно-метанольных растворителей имеет вид
DrGod(HAc) = (37,3 ± 2,8) + (3,62 ± 0,51)·eN-1 – (13,2 ± 2,7)·d2N
n =22; s = 0.63; F(2,19) = 467,6 Fкр(2,19) =3.52;
r = 0.990,
где
n – число экспериментальных
точек; s – стандартная ошибка
аппроксимации; Fкр – критический коэффициент Фишера; r – коэффициент корреляции.
Нормальный вероятностный график остатков свидетельствовал
о нормальному их распределении. Анализ остатков и рассчитанные расстояния Махаланобиса и Кука подтвердили адекватность
построенной модели Численная проверка
независимости остатков проведена с помощью теста Durbin–Watson test (Durbin-Watson d = 0,824; Serial correlation
of residuals = 0,567; DL_2 = 1,15 и DU_2
= 1,54).
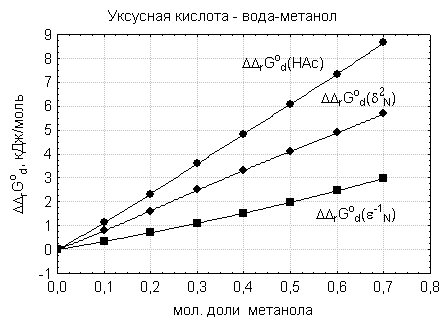
Рис.
1 Влияние плотности энергии
когезии и диэлектрических свойств смешанных
растворителей вода-метанол на уменьшение силы уксусной кислоты
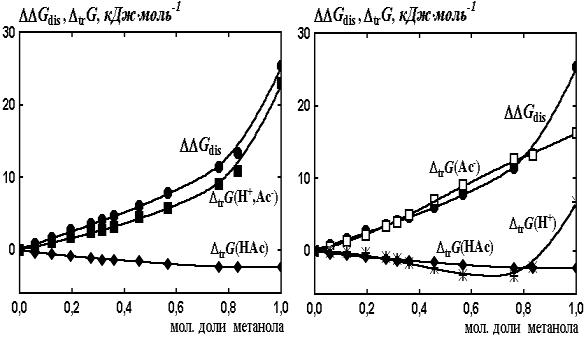
Рис.
2 Результаты
сольватационно-термодинамического анализа диссоциации уксусной кислоты в
водно-метанольных растворителях
Как видно из рис. 1 и 2, результаты
корреляционно-регрессионного анализа находятся в соответствии с данными
сольватационно-термодинамического анализа – уменьшение силы уксусной кислоты в
водно-метанольных растворителях по сравнению с водой обусловлено возрастанием
сольватации недиссоциированных молекул кислоты и уменьшением сольватации
ацетат- ионов.