Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Белевцова Т.В.,
*Бондарев Н.В., **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Моделирование
Гальвани-потенциала границы раздела фаз водный раствор / мицеллярный раствор
ионогенных ПАВ при распределении бензойной кислоты
В работе рассматривается электрохимический подход для
количественного описания химических равновесий диссоциации бензойной кислоты в модельных мицеллярных растворах ионогенных ПАВ.
Цель работы: разработка электрохимической модели
образования двойного электрического слоя по адсорбционно-нейтрализационному
механизму в растворах ионогенных ПАВ
Задачи исследования: обосновать возможность
использования водно-этиленгликолевых растворителей в качестве моделей
стандартного состояния ионов и молекул бензойной кислоты в мицеллах ионогенных
ПАВ; на основе
адсорбционно-нейтрализационного механизма образования двойного электрического
слоя в растворах ионогенных ПАВ оценить Гальвани-потенциал границы раздела
псевдофаза / водный раствор бензойной кислоты; оценить влияние различных
факторов на межфазный потенциал в растворах катионных и анионных ПАВ.
Объект исследования: кислотно-основные
равновесия слабых электролитов в растворах ионогенных ПАВ
Предмет исследования: межфазный потенциал; первичные
эффекты водно-органических растворителей; адсорбционно-нейтрализационный
механизм образования ДЭС в растворах ионогенных ПАВ; термодинамический критерий самопроизвольного возникновения ДЭС;
критическая концентрация мицеллообразования.
Методы исследования: электрохимический;
сольватационно-термодинамический анализ.
Научная новизна исследования: показана возможность
использования водно-этиленгликолевых растворителей как моделей стандартного
состояния для ионов и молекул бензойной кислоты в мицеллах ионогенных ПАВ.
Практическое значение: управление критической
концентрацией мицеллообразования в растворах ионогенных ПАВ посредством слабых
электролитов; предложен способ оценки межфазного потенциала.
В основу модельного подхода положены следующие
положения: адсорбционно-нейтрализационный механизм образования двойного электрического слоя на границе псевдофаза / водный раствор; термодинамический
критерий самопроизвольного образования двойного электрического слоя ![]() ; термодинамика равновесий диссоциации бензойной кислоты в
водно-этиленгликолевых растворителях; тетрафениларсоний-тетрафенилборатная
гипотеза деления стандартных энергий Гиббса переноса электролитов между
растворителями на ионные составляющие; допущение об идентичности стандартного
состояния для равновесия диссоциации бензойной кислоты в мицеллярной фазе и водно-этиленгликолевых
растворителях.
; термодинамика равновесий диссоциации бензойной кислоты в
водно-этиленгликолевых растворителях; тетрафениларсоний-тетрафенилборатная
гипотеза деления стандартных энергий Гиббса переноса электролитов между
растворителями на ионные составляющие; допущение об идентичности стандартного
состояния для равновесия диссоциации бензойной кислоты в мицеллярной фазе и водно-этиленгликолевых
растворителях.
Уравнения, отражающие влияние первичных эффектов среды
(![]() ,
, ![]() ), равновесных концентраций ионов (
), равновесных концентраций ионов (![]() ,
, ![]() ) и молекул (
) и молекул (![]() ) слабой кислоты и первичных солевых эффектов (
) слабой кислоты и первичных солевых эффектов (![]() ,
, ![]() ,
, ![]() ) на Гальвани-потенциал границы раздела водный раствор/псевдофаза
катионных ПАВ (изменение электрической энергии Гиббса) имеют вид:
) на Гальвани-потенциал границы раздела водный раствор/псевдофаза
катионных ПАВ (изменение электрической энергии Гиббса) имеют вид:
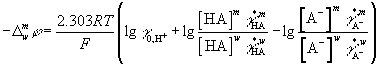 или
или
DGэл(H+) = – FDφ = – F(φm – φw) = DtrGo(H+) + DG([HA]) – DG([A-]) –
DG(γ*A-).
для границы раздела водный раствор/псевдофаза анионных
ПАВ:
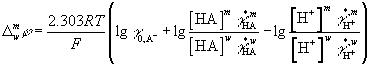 или
или
DGэл(A-) = FDφ
= F(φm – φw) = DtrGo(A-) + DG([HA]) – DG([H+]) – DG(γ*H+)
Коэффициент
распределения уксусной кислоты между водным раствором и псевдофазой варьировали
от 0,001 до 10. Начальные концентрации кислоты варьировали от 0,1 до 1
моль/(кг растворителя).
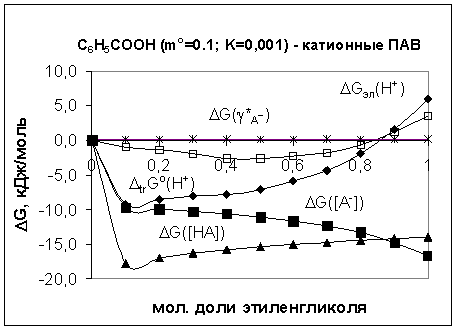
Рисунок.
Влияние первичных эффектов среды, коэффициентов активности и равновесных концентраций ионов и молекул
бензойной кислоты на энергию Гиббса образования ДЭС в растворах катионных ПАВ
Показано, что образованию ДЭС по адсорбционно-нейтрализационному
механизму в растворах ионогенных ПАВ отвечают коэффициенты распределения бензойной
кислоты меньше 0.1 и идентичность стандартного состояния ионов и молекул бензойной
кислоты в мицеллярной фазе и в водно-этиленгликолевых растворителях: вода-этиленгликоль
(0.6-0.7 мол. д. ЭГ) – для мицелл катионных ПАВ (рисунок) и
вода-этиленгликоль (0.5-0,6 мол. д. ЭГ) – для
мицелл анионных ПАВ. Межфазный скачок потенциала практически не зависит от
изменения исходной концентрации карбоновой кислоты. Возрастание ионной силы водного
раствора повышает межфазный потенциал модельных микрогетерогенных систем.