Медицина / 7.
д.т.н., проф. Родионов И.В.
Саратовский государственный
технический университет, Россия
Статья подготовлена при
поддержке гранта Президента РФ
МК-1799.2011.8.
Металлооксидные покрытия с остеокондуктивными свойствами на остеофиксаторах из нержавеющей стали 12Х18Н9Т
Исследования
в области разработки и создания биосовместимых материалов и покрытий
способствовали успешному интенсивному развитию имплантологии как современной
биотехнической науки. Исследования различных свойств и характеристик металлических
и неметаллических материалов выявили новые практические возможности их эффективного
использования в разнообразных хирургических конструкциях, вживляемых в структуры
и системы организма для выполнения определенных функций (Вильямс Д., Роуф Р. Имплантаты
в хирургии, 1978 г.; Штильман М.И. Полимеры медико-биологического назначения,
2006 г.). Исследования показали, что наилучшую приживляемость проявляют изделия
со специальными функциональными покрытиями на основе кальцийфосфатной (гидроксиапатитовой)
керамики, ряда биостекол, углерода и некоторых других нетоксичных материалов
(Лясников В.Н. и др. Биоактивные материалы и покрытия в дентальной имплантологии,
2004 г.; Штейнгард М.З., 1996 г.; Карлов А.В., 2001 г.; Левченко В.А. и др.,
2008 г.). При этом особый научный интерес в настоящее время вызывают исследования
физико-химических, механических и биологических свойств ряда металлооксидных
соединений для получения биосовместимых покрытий, способных интегрироваться
(срастаться) с костной тканью. Этот новый вид функциональных покрытий в
ближайшем будущем может с высокой эффективностью использоваться в различных
технических системах и конструкциях имплантационного назначения, выполняемых их
разных металлов и сплавов.
В
настоящее время разработаны общие основы процессов взаимодействия медицинских
материалов с биоструктурами, исследован механизм первичных стадий взаимодействия
поверхностей имплантируемых материалов с белками, ферментными системами крови,
мягкими и твердыми (костными) тканями организма (Севастьянов В.И., Кирпичников М.И. Биосовместимые материалы,
2011 г.; Хенч Л., Джонс Д. Биоматериалы, искусственные органы и инжиниринг
тканей, 2007 г.). Однако для каждого биосовместимого материала и вида биосовместимого
покрытия требуется проведение отдельного комплекса экспериментальных
исследований их свойств и функциональных особенностей, изучение зависимостей
формирования матричной структуры и характеристик материала от технологических
параметров процесса его получения, а также установление закономерностей, механизмов
и характера взаимодействия с биологическими структурами. На основе результатов
детального теоретического и экспериментального анализов указанных положений
разрабатывается методология и формулируются принципы создания того или иного
биосовместимого материала либо функционального покрытия. Поэтому выполнение
исследований по созданию нового вида оксидного покрытия, обладающего качествами
совместимости с биосистемами и способностью интеграционного взаимодействия с
костными структурами, позволит получить целый комплекс новых научных данных о
влиянии ряда металлооксидных соединений на физико-химические процессы,
протекающие в контактирующих биосредах, а также позволит установить ранее
неизвестные закономерности этого контактного взаимодействия.
Формирование
оксидных покрытий осуществляется с использованием способов электрохимического и
газотермического оксидирования путем применения различных электролитов и
газовых сред соответственно. Данные способы являются широко распространенными в
мировом промышленном производстве металлоизделий для машино-, приборо-, судо- и авиастроения, энергетики и
многих других отраслей. При этом большинство ранее выполненных работ по
оксидированию металлов и их сплавов было посвящено созданию покрытий с высокими
показателями износостойкости, электроизоляционных качеств, защитных свойств,
обусловленными наличием у оксидных покрытий значительной твердости и
структурной плотности при минимальной
пористости, малой шероховатости и невысокой морфологической
гетерогенности поверхности (Томашов Н.Д., Жук Н.П., Акимов Г.В., Фрумкин А.Н.,
Лайнер В.И., Цыпин М.И., Кистяковский В.А., Грилихес С.Я., Архаров В.И., Тодт
Ф., Эванс Ю.Р., Дженкинс А.Е., Биркс Н., Бенар Ж. и др.). Покрытия с такими
характеристиками являются низкоэффективными и малопригодными для медицинских
металлоизделий (имплантатов), где необходима относительно высокая открытая пористость
и развитая структура поверхности.
Прогресс в
направлении создания металлоксидных биосовместимых покрытий сдерживается
недостаточным объемом проведенных научных исследований влияния условий
обработки на комплекс физико-химических, механических и биологических свойств
оксидированных поверхностей. Ранее выполненные исследования практически не
затрагивают вопросы систематизации и разработки научных основ получения
металлооксидных покрытий с качествами биосовместимости и остеокондуктивными
свойствами. Кроме того, отсутствуют научные теоретико-экспериментальные
положения результатов комплексных исследований функциональных характеристик
такого вида покрытий.
Возможность
получения и практического использования металлооксидных покрытий на медицинских
изделиях, функционирующих в костных структурах, является весьма актуальной,
т.к. создаваемые на поверхности изделий металлооксидные слои способны обеспечить
повышенный уровень их адаптации к окружающим условиям. При этом известно, что
большинство разрабатываемых и получаемых на металлах функциональных оксидных
покрытий широко применяется в технических системах различного назначения и
служит для нужд микроэлектроники, машиностроения, химического аппаратостроения
и многих других отраслей промышленности, тогда как возможность использования
металлооксидных покрытий в медицине является сильно ограниченной из-за
отсутствия результатов комплексных исследований таких свойств поверхностных
оксидов, которые определяют их совместимость с биосистемами и способность
интеграционного взаимодействия с тканями организма. Ранее оксидные покрытия
формировались на металлах, в основном, с целью повышения их защитных свойств,
электроизоляционной способности, износостойкости, а также для декоративной
отделки, но в качестве функциональных покрытий медицинского назначения не
рассматривались.
Поэтому исследование и
разработка металлооксидных
покрытий с новыми свойствами и качествами биосовместимости позволит расширить
спектр областей применения конструкционных металлических материалов в медицинской
технике.
Авторскими исследованиями доказано, что оксидные покрытия обеспечивают защиту металлической основы от коррозионного воздействия сред организма (кровь, лимфа, тканевая жидкость) благодаря электрохимическому защитному действию, существенно понижая склонность оксидированной поверхности к коррозии. Пассивированные, коррозионностойкие металлические поверхности не вызывают длительных аллергических реакций организма, а также не оказывают токсикологического действия на окружающие биоструктуры, что относится к основным показателям качеств их биосовместимости.
Эффективная взаимосвязь металлооксидного покрытия с костной тканью обеспечивается за счет их физико-механического сцепления. Такая способность обусловлена наличием у покрытий системы элементов поверхности, характеризуемой выраженной шероховатостью и морфологической гетерогенностью. Структурно-гетерогенная, пористая поверхность покрытий обеспечивает лучший контактный рост кости с более интенсивным протеканием тканевых реакций в сравнении с поверхностью, имеющей гладкий, однородный микрорельеф. Поэтому развитая оксидированная поверхность способствует, во-первых, активному прорастанию костных клеточных структур в поры и углубления оксидного слоя с протеканием процесса остеоинтеграции, во-вторых – направленной регенерации кости и ускоренному остеогенезу. В этих условиях происходит интенсификация деятельности биоструктур, стимулируется образование новой костной ткани и новых кровеносных микрорусел, восстанавливаются нормальные биологические процессы в зоне имплантации. Вместе с тем, металлооксидные покрытия обладают высокими показателями механических свойств, характеризующими их необходимую механическую прочность при функционировании в костных структурах.
Целью работы являлось экспериментальное исследование остеокондуктивных свойств газотермических металлооксидных покрытий, формируемых на чрескостных ортопедических остеофиксаторах из нержавеющей хромоникелевой стали 12Х18Н9Т.
Методика исследования
Опытные
остеофиксаторы представляли винтовые стержни из биотолерантной нержавеющей
стали 12Х18Н9Т (ГОСТ 5632-72), обладающей необходимой биомеханической
совместимостью. Стержни изготавливались путем токарной обработки и подвергались пескоструйной обдувке
поверхности для удаления загрязняющих слоев и создания исходной
микрошероховатости. Формирование оксидных покрытий на стержневых остеофиксаторах
осуществлялось методом воздушно-термического оксидирования и проводилось в
лабораторной кварцевой электропечи сопротивления. Газотермическая обработка
проводилась при температуре 400, 500, 600, 7000С с
продолжительностью 0,5 ч при каждой температуре.
Клинические
испытания опытных фиксаторов проводились в течение 45 суток на лабораторных
кроликах породы «нидерландская красная», которые были разделены на 6 опытных
групп по 3 животных в каждой. Номер опытной группы животных соответствовал
номеру опытной серии фиксаторов, полученных различными способами обработки. При
этом 1 группа животных являлась контрольной, данной группе животных имплантировались
стержни без оксидного покрытия. 2 группе животных вводились стержни без оксидного
покрытия, но с исходной микрошероховатой поверхностью, полученной с помощью
пескоструйной обработки корундовым абразивом. 3-6 группам животных устанавливались
стержни с воздушно-термическими оксидными покрытиями, полученными при
температуре 400, 500, 600 и 7000С соответственно.
После выполнения экспериментального флексионного
перелома большой берцовой кости в области средней трети диафиза, в отломках
просверливались каналы для вворачивания фиксаторов. Учитывая, что прочностные
характеристики кости на разных участках ее длины имеют существенные отличия,
фиксаторы каждой опытной серии устанавливались как в метафизарные, так и в диафизарные
участки костей животных.
Фиксирующие элементы
вворачивались вручную с помощью рукоятки из комплекта аппарата Г.А. Илизарова,
после чего проводилась закрытая репозиция отломков. Их внешняя фиксация
выполнялась в аппарате, состоящем из кронштейнов и многодырчатой планки. В
постоперационный период всем животным проводилась превентивная антибиотиковая
терапия цефазолином, санация зоны контакта «фиксатор – кость» 3%-м раствором перекиси
водорода, а также выполнялись
клинические и гистологические исследования. При этом для получения тонких
срезов (слоев) парафинизированной биоткани и их последующего микроскопирования
с целью гистологического исследования применялся санный микротом МС-2.
Полученные
результаты и их анализ
При гистологических исследованиях костной ткани были выявлены следующие изменения: в образцах, полученных от животных 1 (контрольной) группы, кость была представлена компактной 1 и губчатой тканями, трабекулы значительно склерозированы, местами расширены; в зоне введения фиксатора без металлооксидного покрытия отмечались очаги дегенерации кости, разрастание фиброзной ткани с наличием фибробластоподобных клеток, участки скопления остеобластов с умеренной пролиферацией, очаговое скопление лимфоцитов, а также плазмоцитов, что может свидетельствовать о подостром характере воспаления 2 (рис.1). Остеофиксаторы данной серии не проявили остеокондуктивных свойств поверхности с отсутствием интеграционного взаимодействия с костной тканью.

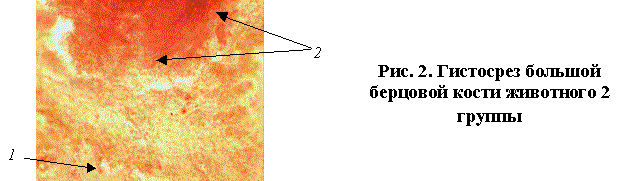
В образцах костей 2 группы лабораторных
животных губчатая костная ткань содержала умеренно склерозированные
полнокровные трабекулы 1 (рис.2). В зоне контакта с остеофиксатором
имелся разрост соединительной ткани с очагами подострого воспаления (лимфоциты,
сегментоядерные лейкоциты в небольшом количестве) 2, наблюдались дегенерация
и присутствие фрагмента молодого хряща.
В образцах костей от 3 и 4 групп животных
выявлено наличие трабекул 1 губчатой костной ткани местами
склерозированых, но полнокровных (рис.3). В месте введения оксидированных
остеофиксаторов есть тонкая фиброзная ткань 2 с фибробластами и остеобластами.
Признаки воспаления отсутствуют, имеется разрост соединительной ткани, что
является признаком начала протекания остеогенеза (рис.3). Это обстоятельство
указывает на наличие определенных остеокондуктивных свойств
воздушно-термических металлооксидных покрытий, полученных на стальных
фиксаторах при температурах 400 и 5000С и продолжительности 0,5 ч.

В образцах костей животных 5 группы костная ткань
была представлена губчатой и компактной структурами с умеренно
склерозированными трабекулами. В зоне введения фиксаторов было заметно наличие
очагов подострого воспаления, при этом отмечалось присутствие молодого
волокнистого хряща, что свидетельствует о формировании молодой костной ткани 1
и наличии выраженных остеокондуктивных свойств у покрытий, полученных при
температуре воздушно-термического оксидирования 6000С (рис.4).

В образцах животных 6 группы отмечалось наличие губчатой костной ткани 1 с несколько расширенными и склерозированными трабекулами. На границе контакта с фиксатором имелся очаг фиброзной ткани 2 с очагово выраженной клеточной инфильтрацией, представленной, в основном, лимфоцитами и сегментоядерными лейкоцитами 3. Кроме того, наблюдались скопления остеобластов с умеренной пролифирацией, что свидетельствует о возникновении острого воспаления (рис.5). Это свидетельствует о неблагоприятном влиянии металлооксидного покрытия, полученного при температуре 7000С и продолжительности 0,5 ч, на приживляемость стальных остеофиксаторов и характер их взаимодействия с окружающими биоструктурами. Фиксаторы с таким покрытием не проявили выраженных остеокондуктивных свойств поверхности при отсутствии интеграционного взаимодействия с костью.

В
результате проведенного клинико-биологического эксперимента можно сделать
следующие выводы: отсутствие существенных воспалительных осложнений у животных
3-5 групп в ранний постоперационный период (7 суток), отсутствие микроподвижности
фиксаторов в отдаленный период (45 суток), необходимость применения ключа для
вывертывания фиксаторов по окончании эксперимента могут служить клиническим
свидетельством наличия остеоинтеграционных способности и остеокондуктивных
свойств у оксидных покрытий, полученных воздушно-термической обработкой при
температурах 400, 500 и 6000С.
Стальные
фиксаторы без покрытия и с покрытием, созданным воздушно-термическим
оксидированием при температуре 7000С, не обеспечили интеграционного
взаимодействия с окружающей костной тканью, не проявили остеокондуктивной способности.
Выводы
1. Результатами
выполненных исследований доказана принципиальная возможность высокоэффективного
применения чрескостных фиксаторов из нержавеющей стали 12Х18Н9Т с
металлооксидными биосовместимыми покрытиями, полученными методом
воздушно-термического оксидирования.
2. Путем проведения гистологических
исследований установлено, что наличие в губчатой ткани гистосрезов
полнокровных, незначительно склерозированных трабекул, а на границе с остеофиксатором
молодой фиброзной ткани с присутствием большого количества изобилующих фибро- и
остеобластов, свидетельствует о высоком уровне остеокондуктивных свойств у
покрытий стальных чрескостных фиксаторов, созданных воздушно-термическим
оксидированием при температурах 400, 500 и 6000С и продолжительности
0,5 ч.