Бочкарев В.В., Тихонова А.С.,
Чайкина А.А., Пустовойтов А.В.
Томский политехнический
университет, Россия
Растворимость
и Кислотность 4-нитро- и 4-нитрозодифениламинов в водных растворах
К настоящему времени разработаны новые способы
получения 4-аминодифениламина (4-АДФА), сущность которых состоит в конденсации
нитробензола с анилином в щелочной среде в присутствии солей тетраалкиламмония,
с образованием смеси солей 4-нитродифениламина (4-нитроДФА) и 4-нитрозодифениламина
(4-нитрозоДФА) и последующим их каталитическим гидрированием до 4-АДФА [1]. Гидрирование
4-нитро- и 4-нитрозоДФА может проводится после их выделения из реакционной
массы стадии конденсации, так и без выделения. Выделение 4-нитроДФА и 4-нитрозоДФА
проводится методом дробного осаждения при подкислении реакционной смеси [2].
Полнота осаждения, а также чистота осажденных продуктов определяется выбором pH
среды реакционной массы при осаждении, количеством воды при разбавлении. Выбор
же pH среды обусловлен величинами pKa осаждаемых соединений.
Особенностью 4-нитроДФА и 4-нитрозоДФА является
то, что эти оба соединения могут проявлять как основные, так и кислотные
свойства. Основные свойства этих веществ, ввиду присутствия в молекулах
акцепторных групп, проявляются только в сильнокислых растворах, например для
4-нитроДФА pKBH+ = ‑3,13 [3]. В нейтральных и
щелочных растворах 4-нитроДФА и 4-нитрозоДФА могут проявлять кислотные свойства
и существовать в растворах в виде нейтральных соединений и их солей, что
неоднократно отмечалось в патентных [1,2] и литературных источниках [4].
В литературе отсутствуют данные о кислотных
свойствах 4-нитроДФА и 4-нитрозоДФА в водных растворах, а также о растворимости
их солей в воде. Поэтому выбор условий выделения из реакционной массы продуктов
конденсации анилина с нитробензолом затруднителен. Кроме этого, не исключается
возможность существования 4-нитроДФА и 4-нитрозоДФА в виде N‑H
или O‑H изомеров. Это, в свою
очередь, накладывает определенные трудности при определении их кислотности.
Целью настоящей работы явилось решение важной
технологической проблемы – определение условий выделения 4-нитроДФА и
4-нитрозоДФА из реакционной массы стадии конденсации анилина с нитробензолом.
При этом решались следующие задачи:
·
оценка
при помощи полуэмпирических квантово-химических методов относительной
устойчивости N‑H и O‑H
изомеров 4-нитроДФА и 4-нитрозоДФА;
·
определение
констант кислотной диссоциации 4-нитроДФА и 4-нитрозоДФА в воде;
·
определение
растворимости 4-нитроДФА и 4-нитрозоДФА и их Na-солей в водных
растворах;
·
выработка
практических рекомендаций по выделению 4-нитроДФА и 4-нитрозоДФА из реакционной
смеси, получающейся на стадии конденсации анилина с нитробензолом.
Экспериментальная
часть
Нитробензол, изопропиловый
спирт, гидроксид калия, гидроксид натрия использовались квалификации «х.ч.».
Анилин очищали двойной перегонкой под вакуумом (~2 кПа) непосредственно перед
использованием. 4-НитроДФА (температура плавления 134¼135 °С) получали из анилина и п-бромнитробензола по методике, описанной в патенте [5]. 4-НитрозоДФА
(температура плавления 142¼143 °С) синтезировали нитрозированием дифениламина до N-нитрозоДФА [6], с последующей перегруппировкой последнего
до 4-нитрозоДФА [7].
Электронные спектры поглощения
4-нитрозоДФА и 4-нитроДФА записывали с помощью спектрофотометра СФ-46 в кварцевых
кюветах с толщиной слоя 1 см в диапазоне длин волн 220¼600 нм. Калибровку pH-метра ЭВ-74 проводили при 20 °С по двум буферным
растворам: фосфатный буфер ГОСТ 8.135-74, рН=6,86; 0,1 н соляная кислота, ГОСТ
14261-77, рН=1,10. Определение pKa 4-нитрозоДФА и 4-нитроДФА проводили по стандартной
методике [8].
С целью выбора метода расчета и моделирования
кислотно-основного взаимодействия нами были проведены тестовые расчеты разными
методами с использованием программ Mopac 2009 и ChemBio3D
Ultra 12.0. В качестве тестовых реакций использовали простые
кислотно-основные реакции взаимодействия гидроксид-иона с протоном и с молекулой
воды. Расчетные значения энтальпии образования реагентов и продуктов приведены
в табл. 1, а энтальпии реакций – в табл. 2.
Таблица 1. Расчетные и экспериментальные данные
по энтальпиям образования реагентов, ∆H°f(298),
кДж/моль
|
Вещество |
Метод |
Экспериментальные данные |
||||
|
MNDO |
AM1 |
PM3 |
PM6 |
3-21G |
||
|
H+(г) |
1536,21* |
1536,21* |
1536,21* |
1536,21* |
1536,21* |
1536,21 [9] |
|
OH–(г) |
–24,17 |
–59,08 |
–73,23 |
–138,21 |
26,14 |
–134,53
[9] |
|
H2O (г) |
–255,00 |
–247,90 |
–223,55 |
–227,21 |
67,11 |
–241,82
[10] |
*Экспериментальные
данные.
Таблица
2. Расчетные и экспериментальные данные по энтальпиям реакций, ∆H°r(298),
кДж/моль
|
Метод |
Экспериментальные данные |
||||
|
MNDO |
AM1 |
PM3 |
PM6 |
3-21G |
|
|
|
|||||
|
–1767,04* |
–1725,04* |
–1686,53* |
–1625,21* |
–1495,24* |
–1643,50* |
|
|
|||||
|
38,87** |
92,49** |
109,77** |
143,99** |
–0,29* |
112,00 [11] |
*Определена
расчетным путем ![]() .
.
**Определена
по изменению энтальпии образования реагирующей системы, при изменении
расстояния между реагентами с 50 Å до оптимального.
Как видно из представленных данных, наименьшее
расхождение между экспериментальными данными и данными, полученными расчетными
методами, наблюдается для методов PM3 и PM6.
Неэмпирический метод с параметризацией 3-21G дает наибольшие отклонения
расчетных величин от экспериментальных данных и поэтому не может быть использован
для моделирования кислотно-основного взаимодействия. Учитывая то, что метод PM6 корректно
воспроизводит энтальпии образования как нейтральных веществ (H2O),
так и ионов (OH–), в дальнейших расчетах пользовались
полуэмпирическим методом PM6.
Результаты и их
обсуждение
4-НитроДФА и 4-нитрозоДФА могут существовать в
виде NH- и OH-форм, и поэтому для них
справедлива следующая система равновесных превращений:
·
для
4-нитроДФА
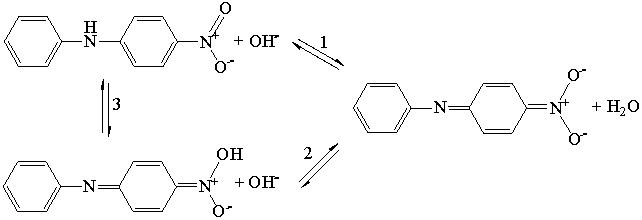
·
для
4-нитрозоДФА
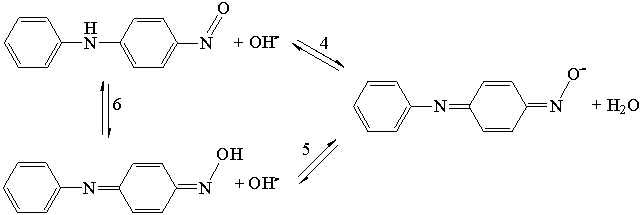
В табл. 3 представлены расчетные
термодинамические величины реагентов и продуктов кислотно-основного
взаимодействия 4-нитроДФА и 4-нитрозоДФА, полученные методом PM6.
Таблица 3. Расчетные термодинамические величины
реагентов и продуктов кислотно-основного взаимодействия 4-нитроДФА и
4-нитрозоДФА
|
Вещество |
DH°f(298),
кДж/моль |
C°p(298), Дж/(моль×K) |
S°(298), Дж/(моль×K) |
|
4-нитроДФА
(NH-форма) |
170,7 |
221,7 |
489,9 |
|
4-нитроДФА
(OH-форма) |
255,0 |
225,3 |
494,0 |
|
Анион
4-нитроДФА |
–28,9 |
214,2 |
480,6 |
|
4-нитрозоДФА
(NH-форма) |
292,7 |
211,9 |
474,9 |
|
4-нитрозоДФА
(OH-форма) |
319,8 |
212,8 |
484,7 |
|
Анион 4-нитрозоДФА |
111,5 |
204,1 |
466,9 |
Используя полученные
расчетные термодинамические величины можно оценить величины DH°r и DG°r для реакций 1¼6 и относительную устойчивость
NH- и OH-форм исследуемых
соединений (см. табл. 4).
Таблица 4. Расчетные термодинамические величины
реакций взаимодействия 4-нитроДФА и 4-нитрозоДФА с гидроксид-ионом
|
Реакция |
ΔH°r(298), кДж/моль |
ΔS°r(298), Дж/(моль×K) |
ΔG°r(298), кДж/моль |
|
1 |
–306,9 |
8,1 |
–309,3 |
|
2 |
–391,2 |
3,9 |
–392,4 |
|
3 |
84,4 |
4,2 |
83,1 |
|
4 |
–288,5 |
9,3 |
–291,2 |
|
5 |
–315,6 |
–0,5 |
–315,5 |
|
6 |
27,1 |
9,7 |
24,2 |
Значения
термодинамических величин DH°r
и DG°r для реакций 3 и 6 свидетельствуют,
что NH-форма термодинамически более устойчива чем OH-форма
как для 4-нитроДФА, так и для 4-нитрозоДФА. Логично предположить, что в
растворах 4-нитроДФА и 4-нитрозоДФА преимущественно будут существовать только в
виде NH-форм.
Для записи спектров 4-нитрозоДФА и 4-нитроДФА
готовили их 0,01 М растворы в изопропиловым спирте. Из исходных растворов были
приготовлены рабочие водные растворы 4-нитрозоДФА (0,04 ммоль/л) и 4-нитроДФА
(0,05 ммоль/л) в нейтральной и щелочной средах. Соответствующие спектры приведены
на рисунок.
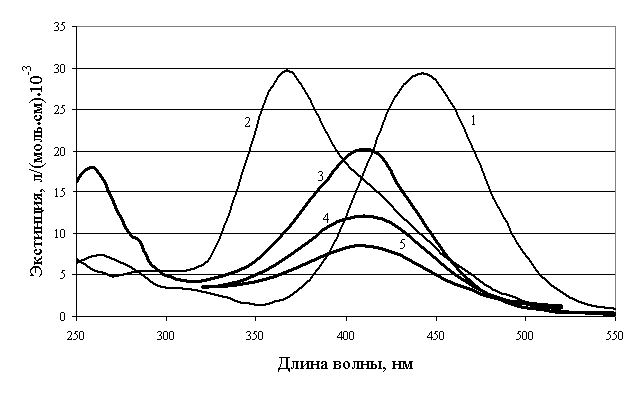
Рисунок. Электронные спектры
поглощения водных растворов 4-нитрозоДФА (1 ‑ pH=5,61;
2 ‑ pH=11,40) и 4-нитроДФА (3 ‑ pH=2,00;
4 ‑ pH=4,35; 5 ‑ pH=7,17).
Из спектра поглощения
4-нитрозоДФА видно, что для 4-нитрозоДФА в нейтральной среде характерна полоса
поглощения с максимумом при 440 нм. В щелочной среде интенсивность полосы
поглощения при 440 нм уменьшается, и появляется новая полоса с максимумом при 370
нм. В качестве аналитической длины волны для определения pKa можно выбрать 370 или
440 нм. Для 4-нитроДФА в нейтральной среде характерно полоса поглощения с максимумом
при 410 нм. При увеличении pH раствора интенсивность
полосы поглощения при 410 нм уменьшается, причем происходит значительное
уширение полосы поглощения. В качестве аналитической длины волны для
определения pKa можно выбрать 410 нм.
Для определения pKa была приготовлена
изомолярная серия рабочих растворов (0,06 ммоль/л), отличающихся значением pH.
Была замерена оптическая плотность рабочих растворов на нескольких длинах волн,
соответствующих максимальной разнице между оптической плотностью в спектрах
нейтральной и щелочной форм. Среднее значение константы кислотности для
4-нитрозоДФА рКа=9,43±0,02,
для 4-нитроДФА рКа=4,40±0,05.
Для определения условий
осаждения продуктов реакции из реакционной смеси было проведено определение
растворимости в воде 4-нитро- и 4-нитрозоДФА. Были приготовлены насыщенные
растворы 4-нитрозоДФА и 4-нитроДФА в воде и в 0,1 н растворе NaOH. Растворы были выдержаны в течении 24 ч при 20±1 °С для установления полного насыщения. По величине оптической плотности
растворов при длине волны, отвечающей максимуму поглощения соответствующей
формы, были определены концентрации веществ в насыщенном растворе и их
растворимости. Растворимость исследуемых соединений в воде при 20 ○С:
4-нитродифениламина – 0,019 г/л; 4-нитрозодифениламина – 0,031 г/л; их натриевых
солей – 0,066 и 5,610 г/л соответственно. Полученные результаты по
растворимости нейтральных соединений в воде достаточно хорошо согласуются с
литературными данными [12, 13].
По результатам проделанной
работы можно сделать практические рекомендации, касающиеся выделения 4-нитроДФА
и 4-нитрозоДФА из реакционной смеси, получающейся на стадии конденсации анилина
с нитробензолом. Реакционная масса, получающаяся на стадии конденсации, имеет
щелочную реакцию (pH>12), и продукты находятся в
растворе в виде солей тетраметиламмония. Для выделения продуктов конденсации
реакционную массу подкисляют до pH 7,0¼7,5, при этом более 99 % аниона 4-нитрозоДФА переходит
в нейтральную форму и вследствие меньшей растворимости 4-нитрозоДФА осаждается.
После отделения 4-нитрозоДФА, оставшийся фильтрат подкисляют до pH 2,5¼3,0, происходит осаждение 4-нитроДФА.
Эти рекомендации были опробованы в ряде синтезов,
проведенных по методике, описанной в примерах 1,2 патента [14]. В колбу
загружали 25 см3 анионита DOWEX Marathon MSA, 11,5 г 35 %
раствора NaOH (0,0936 моля NaOH), 37,8 г (0,4065 моля) анилина, нагревали до
температуры 60 °C и начинали дозировку нитробензола в количестве 10 г (0,0813
моля). Продолжительность дозирования нитробензола 90 минут, продолжительность
синтеза – 6 ч. Содержание непрореагировавшего нитробензола и продуктов реакции
в реакционной массе определяли методом высокоэффективной жидкостной
хроматографии на приборе «Милихром А-02». Характеристика колонки: диаметр – 2
мм; длина – 75 мм; сорбент ProntoSIL 120-5-C18 AQ #1810;
размер частиц 5 мкм; эффективность колонки – 5300 теоретических тарелок. Анализ
проводили при температуре 35 °С, давлении 1,9 МПа и длине волны 270 и
360 нм.
После проведения синтеза, всю реакционную массу
отфильтровывают на фильтре Шотта от катализатора. Катализатор промывают последовательно
5-ю порциями (по 100 см3) 2 н водного раствора NaOH и 3-я порциями (по 100 см3) дистиллированной
воды и сушат на воздухе. Промывные воды присоединяют к реакционной массе.
Реакционную смесь подкисляют до pH 7,0¼7,5 концентрированной
HCl, отгоняют 200¼250 см3 азеотропной
смеси вода анилин–нитробензол, охлаждают до 5¼10 °С и
отфильтровывают осадок 4-нитрозоДФА (температура плавления 140¼142 °С).
Фильтрат подкисляют до pH 2,5¼3,0,
отфильтровывают осадок 4-нитроДФА (температура плавления 131¼133 °С).
Средние результаты по трем синтезам (в атмосфере азота):
конверсия нитробензола – 0,984; выход: 4-нитрозоДФА – 80,6 %; 4-нитроДФА – 14,6
%; потери продуктов с фильтратом и механические потери – 3,2 %.
Средние результаты по трем синтезам (в атмосфере
воздуха): конверсия нитробензола – 0,986; выход: 4-нитрозоДФА – 33,8 %;
4-нитроДФА – 62,1 %; потери продуктов с фильтратом и механические потери – 2,6
%.
Результаты проведенных опытов свидетельствуют о том,
что разработанный способ выделения 4-нитрозоДФА и 4-нитроДФА из реакционной
массы дает хорошие результаты и его можно рекомендовать для препаративного получения
этих веществ.
Выводы
1.
Установлено,
что 4-нитро- и 4-нитрозодифениламин в водных растворах проявляют кислотные
свойства. Полуэмпирическим методом PM6 оценена термодинамическая
вероятность кислотно-основных процессов для 4-нитро- и 4-нитрозодифениламина и показано,
что NH-формы термодинамически более устойчивы OH-форм
как для 4-нитродифениламина, так и для 4-нитрозодифениламина.
2.
Определены
константы кислотной диссоциации 4-нитро- и 4-нитрозодифениламина – 4,40 и 9,43
соответственно.
3.
Определена
растворимость 4-нитродифениламина 0,019 г/л и 4-нитрозодифениламина 0,031 г/л и
их натриевых солей 0,066 и 5,610 г/л в воде при 20 ○С.
Литература
1.
Бочкарев
В.В., Сорока Л.С., Чайкина А.А. Перспективные методы получения
4-аминодифениламина и промежуточных продуктов его синтеза // Известия Томского
политехнического университета. – 2010. – Т. 317. – № 3. – С. 146–152.
2.
Method of preparing
4-aminodiphenylamine: Pat. 5453541 USA. № 157120; Filed 06.12.1993; Pub.
26.09.1995. – 14 p.
3.
Dolman D., Stewart R. An acidity function in
ethanol – sulfuric acid based on the
protonation of diphenylamines // Canad. J. Chem. –
1967. – V. 45.
– № 9. – P. 903–910.
4.
Stern M.K., Hileman F.D., Bashkin
J. K. Direct Coupling of Aniline and Nitrobenzene: A New Example of
Nucleophilic Aromatic Substitution for Hydrogen // J. Amer. Chem. Soc. – 1992.
– V. 114.
– № 23. – P. 9237–9238.
5.
Para-nitrodiphenylamine synthesis: Pat. 4683332 USA. № 735513; Filed
20.05.1985; Pub. 28.07.1987. – 6 p.
6.
Гитис
С.С., Глаз А.И., Иванов А.В. Практикум по органической химии. – М.: Высшая
школа, 1991. – 303 с.
7.
Production of
4-nitrosodiphenylamine: Pat. 3748362
USA. № 27880; Filed
13.04.1970; Pub. 24.07.1973. – 5 p.
8.
Берштейн
И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. – Л.:
Химия, 1975. – 232 с.
9.
Термодинамические свойства индивидуальных веществ. Т. 2: Таблицы термодинамических
свойств / под ред. Л.В. Гурвич и др. – М.: Наука, 1962. – 916 с.
10.
Сталл
Д., Вестрам Э., Зинке Г. Химическая термодинамика органических соединений. – М.:
Мир, 1971. – 944 с.
11.
Meot-Ner M., Speller, C.V. The
Filling of Solvent Shells in Cluster Ions: 1. Thermochemical Criteria and the
Effects of Isomeric Clusters // J. Phys. Chem. – 1986. – V. 90. – № 25. – P. 6616–6624.
12.
ChemDoodle database. URL: http://www.chemexper.com/search/cas/
156105.html (дата обращения: 01.06.2012).
13.
ChemDoodle database. URL: http://www.chemexper.com/search/cas/
836306.html (дата обращения: 01.06.2012).
14.
Способ получения 4-аминодифениламина и промежуточных
продуктов его синтеза: пат. 2369595 Рос. Федерация. № 2008113692/04; заявл. 07.04.2008;
опубл. 10.10.2009. – 9 с.