Биологические
науки/5.Молекулярная биология
Квач С.В., Ерошевская Л.А., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск
ОПРЕДЕЛЕНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА НУКЛЕОЗИДФОСФОТРАНСФЕРАЗЫ ERWINIA HERBICOLA
Природные и
модифицированные нуклеозид-5'-монофосфаты (НМФ) широко используются в научных
исследованиях и как ценные фармакологически-активные субстанции. Например,
инозин-5’-монофосфат (ИМФ) и гуанозин-5’-монофосфат (ГМФ) широко применяются в
качестве пищевых добавок для усиления вкуса [1]. Наиболее широко нашли
применение модифицированные НМФ в качестве фармацевтически важных субстанций,
являющихся основой целого ряда противовирусных и противоопухолевых
лекарственных препаратов. Например, одно из наиболее мощных средств для
химиотерапии В-клеточных лейкемий и не-Ходжкинских лимфом – Флударабин по
химической природе представляет собой 5'-монофосфат 2-фтораденинарабинозида
(2-фтор-aрa-AМФ) [2].
Ранее, с
помощью “shot-gun”-клонирования нами был получен
рекомбинантный штамм Eschrichia coli НФТ-5 [3], несущий плазмиду со вставкой ДНК, кодирующей ген
нуклеозидфосфотрансферазы (НФТ) Erwinia
herbicola, и было показана возможность применения генно-инженерной НФТ для
синтеза аденинарабинозид-5′-монофосфата, соединения, обладающего
выраженной противогерпетической активностью. Особенностью данного штамма является
то, что ген НФТ, содержащийся в клонированной последовательности ДНК, не
контролируется плазмидными промоторами, в связи с чем невозможно управлять
индукцией синтеза белка. Целью данной работы явилось определение
последовательности ДНК, кодирующей НФТ в штамме E. coli НФТ-5.
Материалы и методы. Клетки E.
coli НФТ-5 культивировали в колбах Эрленмейера на термостатированных
биологических качалках с частотой колебания платформы 170–190 об/мин при 37oС
в среде LB следующего состава (%): триптон – 1,0; дрожжевой экстракт – 0,5;
NaCl – 1,0. При скрининге трансформантов в среду вносили ампициллин в
концентрации 200 мкг/мл.
Плазмидную ДНК получали
с использованием набора Wizard Plus SV minipreps DNA purification system
(Promega, США).
Процесс
определения последовательности гена НФТ проводили с использованием набора
реактивов Big Dye Terminator Cycle Sequencing Kit v3.1 (Applied Biosystems,
США) по методике производителя. Секвенирование осуществляли на приборе ABI 310
Genetic Analyser (Applied Biosystems) с использованием следующих праймеров:
M13F – GTAAAACGACGGCCAGT, M13R – GAGGAAACAGCTATGAC, NPT8F(463) –
GGAGGAGACTGCTTTATAGAG, NPT8R(589) – CGCTCATAAACCGCTTCATC, NPT8-2R –
TGGGATTTGCATCCGATACG. Полученные нуклеотидные последовательности сравнивали c
известными последовательностями генов из других организмов в программе NCBI
BLAST.
Результаты
и обсуждение. Для определения 5'- и
3'-концевых фрагментов вставки применяли M13F- и M13R-праймеры к известным
участкам плазмиды pBluescript KS. В дальнейшем
секвенирующие праймеры подбирали, основываясь на полученных результатах о
первичной структуре анализируемой последовательности. В результате была
получена нуклеотидная последовательность плазмидной вставки, содержащей ген НФТ.
Далее, с помощью пакета программ
Vector NTI 10.0 (Invitrogen, США) был проведен поиск открытых рамок считывания
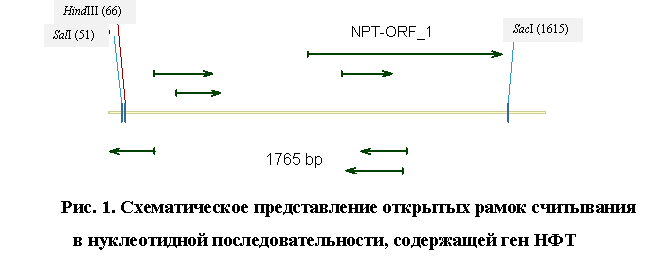
(ORF) для идентификации областей, кодирующих белки. Результаты представлены на
рис. 1. Из рисунка видно, что в последовательности обнаруживается 7 возможных
рамок считывания. Одна из них (NPT-ORF_1) включает в себя 786 пар оснований.
Трансляция данной нуклеотидной последовательности в аминокислотную приведена на
рис. 2. Анализ данной последовательности в программе Vector NTI 10.0 показал,
что белок, состоящий из приведенных аминокислот имеет предполагаемую
молекулярную массу 28 кДа, что приблизительно соответствует полученным
нами результатам по электрофоретическому анализу молекулярной массы нативной НФТ
Erw. herbicola (25
кДа) [4].
1 mkrivkalli livvgavage alaadvtlyv trhgktmfnt vhraqgwadt pltpagveva
61 qklgrglqti pfiavwssda graretaqlv mqawktplpl nerrelrevg fglyegdlnn
121 nmlndaahql gfasdtalme aygkgkvhvd riidairqae asgtpalrgi ksagmaesyq
181 qvakrmvdsl teiaqqarqq gggnvlvvth glaitallqa lgdtslnqtl dnasvtrlry
241 tdsgefvies indmsyvergl
Рис.
2. Аминокислотная последовательность предполагаемого
гена
НФТ
Для определения степени гомологии
полученной последовательности с уже имеющимися в различных банках данных
последовательностями, был проведен BLAST-анализ (www.ncbi.nlm.nih.gov/Blast). В результате
этого анализа было определено, что белок, кодируемый данными аминокислотами,
наиболее гомологичен (Evalue
= 2X10-47) фосфоглицеромутазе Bacillus cereus E33L. При этом степень гомологии составила 63% (рис.
3).
NPT
MKRIVKALLILIVVGAVAGEALAADVTLYVTRHGKTMFNTVHRAQGWADTPLTPAGVEVA 60
PGM MK---------------NRETDSNVVTLYVTRHGKTILNTNHRAQGWADSPLVEKGVEVA
45
** *: : ***********::** ********:**. *****
NPT
QKLGRGLQTIPFIAVWSSDAGRARETAQLVMQAWKTP-LPLNERRELREVGFGLYEGDLN 119
PGM
TNLGTGLKDIHFMNAYSSDSGRAIETANLVLKYSEQSKLKLEQRKKLRELNFGIFEGEKL 105
:** **: * *: .:***:*** ***:**::
: . * *::*::***:.**::**:
NPT NNMLNDAAHQLGFASDTALMEAYGKGKVHVDRIIDAIRQAEASGTPALRGIKSAGMAESY
179
PGM
DNMWDAVGKAAGVASTEELMKFS------IQEVIDLIRAADPT-----------KQAEDW 148
:** : ..: *.** **:
::.:** ** *:.: **.:
NPT QQVAKRMVDSLTEIAQQARQQGGGNVLVVTHGLAITALLQALGDTSLNQTLDNASVTRLR
239
PGM
ELFSTRIKAEIDKISEEAAKDGGGNVLVVVHGLLITTLIEMLDSSKTKLGVENASVTKIV 208
: .:.*: .: :*:::* ::********.***
**:*:: *..:. : ::*****::
NPT YTDSGEFVIESINDMSYVERGL----- 261
PGM YQD-GIYTVESVGDMSYVAKGKESVEI 234
* * * :.:**:.***** :*
Рис. 3. Попарное выравнивание
аминокислотных последовательностей гена НФТ Erwinia herbicola (NPT) и
фосфоглицеромутазы Bacillus cereus (PGM)
Анализ наличия консервативных
доменов с использованием программы BLAST показал, что изучаемый белок
принадлежит к двум большим суперсемействам – phoE (фосфатазы с широкой
специфичностью) и PGAM (фосфоглицеромутазы). Как было показано ранее [4], НФТ
обладает фосфатазной активностью и способна гидролизовать широкий ряд
субстратов, что делает ее похожей на неспецифические фосфатазы, с другой
стороны она, как и представители фосфоглицеромутаз, может переносить фосфат на
гидроксильную группу сахаров. Поэтому полученные данные говорят о том, что
белок, кодируемый последовательностью NPT-ORF_1 может представлять собой
полноразмерную НФТ.
Таким образом, в результате настоящей работы проведено
полное секвенирование гена, кодирующего нуклеозидфосфотрансферазу бактерии Erwinia herbicola. Проведен
сравнительный анализ гомологии аминокислотной последовательности изучаемого
фермента с известными первичными структурами белков с помощью компьютерной
программы «BLAST». Этот анализ позволил отнести нуклеозидфосфотрансферазу Erwinia herbicola к т.н. PGАM- и phoE-суперсемействам, в которое входят белки, обладающие
фосфоглицеромутазной и фосфатазной активностью.
Литература:
1.
Asano, Y. A new enzymatic method of selective phosphorylation of nucleosides /
Y. Asano, Y. Mihara, H. Yamada // J. Mol. Catal. B: Enzymatic. – 1999. – Vol.
6, № 3. – P. 271–277.
2.
Activity of oral fludarabine phosphate in previously treated chronic
lymphocytic leukemia / M. Boogaerts [еt аl.] // J. Clin. Oncol. – 2001. – Vol. 19, № 22. – P.
4252–4258.
3. Use of Erwinia herbicola
recombinant nucleoside phosphotransferase for the synthesis of pharmaceutically
useful nucleoside-5′-monophosphates / S.V. Kvach [еt аl.] // New Aspects
of Biotechnology and Medicine / Eds. A.M. Egorov and G.E. Zaikov. – NY: Nova
Science Publishers, Inc. – 2007. – P. 7–13.
4. Квач, С.В. Выделение и характеристика внутриклеточной
нуклеозидфосфотрансферазы Erwinia
herbicola БИМ В-345 / С.В. Квач, А.И. Зинченко // Весцi НАН Беларусi. Сер.
бiял. навук.– 2005.– № 2.– С. 97–101.