Химия и химические технологии/2.Теоретическая химия
К.х.н. Карибьянц М.А., к.б.н. Мажитова М.В., Якубова Г.В.
Астраханский государственный университет
Исследование системы ауринкомплексон-кобальт
как реагента для идентификации кордиамина
Одной из главных проблем
современности является фальсификация лекарственных препаратов, выпускаемых
фармацевтической промышленностью и поступающих в аптечные магазины. В связи с
этим одной из главных задач аналитической химии является разработка методов и
методик идентификации лекарственных препаратов и их количественного
определения. Одним из простых, доступных и достаточно точных методов
идентификации и количественного определения различных веществ является
спектрофотометрия, основанная на получении ярких аналитических эффектов в
процессе взаимодействия исследуемых соединений с органическими реагентами.
В настоящей работе
приводятся результаты исследования возможности идентификации и количественного
определения одного из широко применяемых в лечебной практике лекарственного
препарата кордиамина. В качестве реагента нами был выбран ауринкомплексон (АК),
один из трифенилметановых красителей группы фталексонов, синтезированный на
кафедре аналитической химии Саратовского педагогического института. Это
восьмиосновная кислота, шесть иминодиацетатных группировок в которой связаны с
бензольными кольцами метиленовыми группами и поэтому непосредственного влияния
на состояние π-электронной системы красителя не оказывают. Две
слабокислотные гидроксильные группы входят в систему сопряжения связей реагента
и, следовательно, влияют на его спектральные характеристики [1]. Для повышения
чувствительности реакции исследование проводили в присутствии ионов кобальта.
В работе применяли 2*10-4
М водный раствор нитрата кобальта, полученного разбавлением 10-2
молярного раствора, приготовленного по точной навеске Co(NO3)2*6H2O марки ХЧ. 10-3
М растворы ауринкомплексона готовили по точной навеске препаратов и разбавляли
до концентрации 2*10-4 непосредственно перед работой. Фармпрепарат кордиамин (Cord) использовали в виде раствора в ампулах объёмом 2 мл
с исходной концентрацией 25% (1,5272 М). Ампулы вскрывались непосредственно
перед работой и разбавлялись до концентрации 0,15272М. Все условия хранения
препарата были соблюдены. Применяли аммиачно-ацетатные и солянокисло-ацетатные
буферные растворы. В готовых аналитических системах рН контролировали на
иономере И-130. Фотометрирование проводили на приборах КФК-3 и спектрофотометре
ПЭ-5400В (СФ ПЭ-5400В). В качестве раствора сравнения использовалась дистиллированная
вода. Все растворы готовились на бидистилляте.
Все опыты проводились не
менее, чем в трех повторностях, для получения калибровочного графика – не
менее, чем в пяти повторностях.
Спектры светопоглощения
красителя и его же в присутствии ионов кобальта, полученных в широком диапазоне
кислотности среды, показали, что наиболее контрастная реакция наблюдается при
рН 5 и соотношении Со :
АК = 1:1 (рис.1).
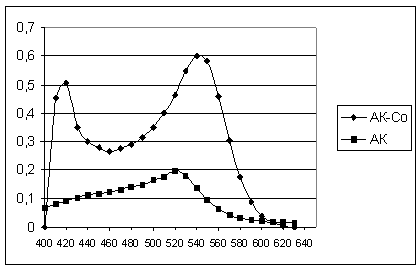
Рисунок 1
Спектры светопоглощения АК и его же в присутствии ионов кобальта
Основные спектрофотометрические характеристики
комплекса приведены в таблице 1.
Таблица 1.
Основные спектрофотометрические характеристики
комплекса АК с ионами Со.
|
рн |
λАКх-
,нм |
λАК,нм |
λк-са,нм |
∆λ,нм |
Me:R |
ε |
|
5 |
560 |
520 |
420/540 |
-100/20 |
1:1 |
0,26*104 |
Простейшее соотношение
Ме:R устанавливали
методами изомолярных серий [2], методом молярных отношений (насыщения) [3] и
методом отношения наклонов [4]. Молярный коэффициент светопоглощения определен
по методу Н.П. Комаря [5].
Введение ионов Со2+
повышает степень поляризованности реагента, в результате инициирования
его диссоциации по слабокислотным группам, входящих в сопряженную систему
красителя. Существует также большая вероятность, что батохромный эффект
обусловлен образованием собственной изолированной электронной системы, представляющей
собой металл, окруженный донорными атомами лиганда. Это полоса достаточно интенсивна
и может быть отнесена к орбитально разрешенным переходам с внутримолекулярным
переносом заряда с лиганда на металл. При этом, как мы полагаем, фенольный
кислород, имеющий две неподеленные пары электронов, поставляет одну пару в
π-электронную систему реагента (вовлекается), а другая пара участвует в
связи с подходящими по симметрии орбиталями металла, причем водород фенольной
группы может не вытесняться [6], что и наблюдается в нашем случае. Тогда
координационный узел может быть отображен в виде схемы.
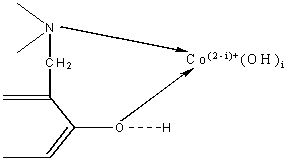
Участие азота иминодиацетатной группировки в цепи было
доказано ИК-спектрофотометрическими исследованиями аналогичных структур [1].
Коротковолновая
полоса поглощения (λ=420 нм) говорит о присутствии в растворе соединения,
степень поляризованности которого меньше, чем самого реагента в слабокислой
среде. Это может быть связано с блокированием цепи сопряжения при образовании
цикла по хиноидной части реагента. В то же время явление гипсохромии при
комплексообразовании может быть вызвано эффектом рассеяния, то есть
прекращением начинающейся диссоциации по гидроксилу и, возможно, образованием
внешних водородных связей и блокированием электронных пар в ОН-группе. Учитывая
состояние ионов металла [7] и реагента [8], уравнение комплексообразования
можно выразить схемой
Co2+ + H4R5- ↔
Co(OH)iH4nRx +
nH+
Спектры
светопоглощения красителя в присутствии кордиамина в широком диапазоне
кислотности среды показали отсутствие смещения полосы поглощения двойной
системы относительно реагента, однако интенсивность окраски возрастает в
слабокислой среде.
Абсорбционные
кривые тройной системы АК – Со2+ - Cord при рН 3 представлены на рисунке 2, основные
спектрофотометрические характеристики системы приведены в таблице 2.
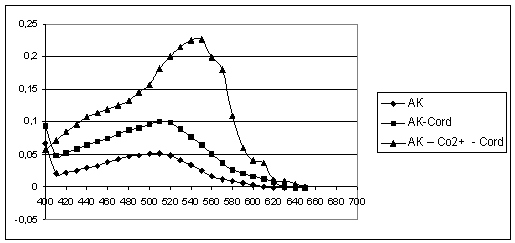
Рисунок 2. Спектры
светопоглощения ауринкомплексона, его же в присутствии кобальта, в присутствии
кордиамина, а также
тройной системы АК – Со2+ - Cord.
Таблица 2
Основные спектрофотометрические
характеристики системы
Co2+-АК-Cord.
|
рН |
λАК,нм |
λАК-Со,нм |
∆λ |
λ Co2+-АК-Cord,нм |
∆λ отн-но λАК |
∆λ
отн-но λ АК-Cord |
|
3 |
510 |
510 |
0 |
550 |
40 |
40 |
С введением
кордиамина в растворы АК в присутствии ионов кобальта в умеренно кислых средах
(рН 3) появляется длинноволновой максимум, полоса поглощения которого совпадает
с полосой поглощения полностью ионизированной формы реагента (560 нм).
По-видимому, введение кордиамина вызывает образование разнолигандного
комплекса, существующего в узком интервале рН. Этот процесс происходит в
условиях избытка кордиамина, который, вероятно, вытесняет молекулы воды из
координационной сферы металла и занимает вакантные места. Соотношение AK:Co остается тем
же (1:1). Образование разнолигандного соединения подтверждается тем фактом, что
в отсутствии кордиамина взаимодействия АК с ионами кобальта не происходит, и в
то же время кордиамин при этой кислотности среды также не влияет на
спектральные характеристики АК. Более глубокая окраска разнолигандного
комплекса (коротковолновой максимум уже отсутствует), по сравнению с таковой
комплекса АК с Со2+ , свидетельствует о возникновении цикла Со по
оксигруппе бензольного кольца АК, и этот процесс сопровождается выделением
протона. Предполагаемая структура определяет высокую полярность соединения. В
то же время, этот комплекс будет малоустойчивым, что подтверждается очень узкой
областью его существования. Учитывая, что наиболее заметная цветная реакция
кордиамина с системой Со – АК наблюдается при рН 3, эту систему можно предложить
в качестве реагента на данный фармпрепарат. Реакцию можно проводить пробирочным
или капельным методами.
Литература.
1. Краснов А.И., Астахова Н.К., Грунин А.В.
Ауринкомплексон как реагент на титан(IV),
железо(III) и висмут// Орг. реагенты в анализе: Межвуз. науч.
сб. Изд-во Саратовского ун-та, 1979. Вып. 3 (5). С. 72-76.
2. Булатов М.И., Калинкин И.П. Практическое руководство
по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия,
1976г., с.178-181
3. Булатов М.И., Калинкин И.П. Практическое руководство
по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия,
1976г., с.181-183Арзамасцев А.П., Печенников В.М., Родионова Г.М., Дорофеев
В.Л., Аксенова Э.Н. Анализ лекарственных смесей.-М.: Компания «Спутник», 2000.
275 с.
4. Булатов М.И., Калинкин И.П. Практическое руководство
по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия,
1976г., с.190-195Современные методы анализа. Научные труды. М. 1988
5. Комарь Н.П.
определение коэффициента молярного погашения и констант равновесия окрашенных
соединений. Ученые записки. Т.37. Труды научно-исследовательского института
химии Харьковского гос. университета, 1951 г., вып. 8, 37
6. Краснов А.И., Рыжов В.Н. Взаимодействие титана (IV) и молибдена (VI) с некоторыми комплексонами./ Органические реагенты в
анализе. Вып. 3(5), 1979 г., с. 79-84Беликов В.Г. Фармацевтическая химия: В 2
ч. М, 1993 Ч. 1. 432 с.; Ч. 2. 608 с.
7. Спицин В.И., Мартыненко Л.И. Неорганическая химия. Ч. I и II: Учебник. М.:
Изд МГУ, 1994г
8. Карибьянц М.А., Мажитова М.В., Кокурина Е.Е., Батина
В.В., Густова Е.В. Материалы III
Международной научной конференции «Фундаментальные и прикладные проблемы
получения новых материалов». Астрахань, 22-24 апреля 2009г., 271с.