К.м.н. Никонова Л.Г.,
д.м.н. Стельникова И.Г.
Нижегородская
Государственная медицинская академия
Реакция элементов микроциркуляторного
русла поджелудочной железы при адаптации организма к непродолжительным
двигательным нагрузкам у животных с нарушенной толерантностью к глюкозе.
Известно, что состояние микроциркуляторного
русла определяет функциональную активность поджелудочной железы как органа и
влияет на выраженность гуморальной связи между элементами экзокринной и
эндокринной паренхимы [1, 2]. Нарушения
в сосудистом русле поджелудочной железы могут служить фактором в патогенезе
сахарного диабета [3, 4, 5]. Физические нагрузки определенной интенсивности
оказывают благотворное воздействие на функционирование сердечно-сосудистой,
дыхательной и других систем организма, улучшают утилизацию глюкозы,
предупреждают развитие осложнений у больных с сахарным диабетом второго типа и
способствуют поддержанию углеводного гомеостаза у лиц с нарушенной
толерантностью к глюкозе [6, 7].
Материалы и методы. Исследование проведено на
20 половозрелых собаках-самцах с нарушенной толерантностью к глюкозе. Первая
группа - интактный контроль (n=10) (без нагрузки),
вторая – экспериментальная (n=10) с применением непродолжительной физической
нагрузки в виде бега по ленте тредмилла со скоростью 15 км/час до оптимальной
стадии, которая определялась по стабилизации показателей ЧСС и ЧД на достаточно
высоком уровне в течение определенного времени. Среднее время бега
составляло 13,25±1,1 минуты. Забор
материала осуществляли под тиопенталовым наркозом из расчета 0,5 мл 10%
раствора тиопентала натрия на 1 кг массы животного. В условиях управляемого
дыхания рассекали переднюю брюшную стенку, извлекали поджелудочную железу.
Кусочки из хвостовой части замораживали
в изооктане, охлажденном до – 70 градусов жидким азотом. Для оценки
морфофункционального состояния микроциркуляторного русла на криостатных срезах
после выявления щелочной фосфатазы (ЩФ) в эндотелии кровеносных капилляров
методом азосочетания по M.M. Nachlass
определяли оптическую плотность ЩФ и измеряли относительный объем (ОО)
капилляров. На основании полученных данных рассчитывался коэффициент
кровоснабжения (ККр) соответственно для каждой частипо формуле Ккр=Д×С,
где Д-средняя оптическая плотность ЩФ, а С- относительный объем капилляров [8].
Относительный объем просвета капилляров каждой части определяли на
парафин-целлоидиновых срезах (фиксация жидкость Буэна, окраска по Ван Гизону).
Морфометрические показатели получали с помощью программы Image
Tools 3.0 и установки анализа изображения МАКС — 1005 [9]. Для
электоронно-микроскопического исследования кусочки фиксировали в 2,5%
глутаральдегиде, дофиксировали 2%
раствором четырёхокиси осмия, заливали в смесь эпон-аралдита. Для идентификации
панкреатических островков с последующей прицельной заточкой с каждого
блока получали полутонкие срезы на
ультратоме Ultracut фирмы Reichert-jung,
окрашивали метиленовым синим, основным фуксином. Ультратонкие срезы
контрастировали уранилацетатом. Исследовали на трансмиссионном электронном
микроскопе Morgagni 268D фирмы FEI
с помощью программы Analysis. Цифровой материал
обрабатывали с применением методов вариационной статистики с учетом
изменчивости признака в пределах каждого организма в программах Microsoft Excel 7.0.
Результаты
и обсуждение. Проведенные исследования показывают, что активность щелочной
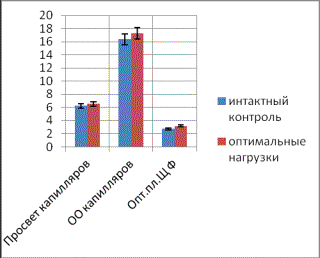
фосфатазы в поджелудочной железе невысока и составляет 2,75±0,016у.е. в сосудах
экзокринной части и 1,13±0,01у.е. в капиллярах панкреатических островков.
Фермент выявляется в эндотелии капилляров в виде петлистой сети вокруг ацинусов
(рис.1а) и извитых линий, формирующих форму кольца в эндокринной части (рис.
1б). Относительный объем капилляров
экзокринной части равен 16,36±1,51 у.е., эндокринной -14,65±1,7 у.е.
Коэффициент кровоснабжения ацинусов - 45,2±8,65, панкреатических островков -
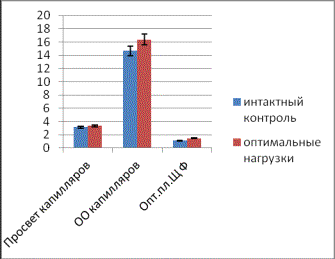
16,8±1,92. После непродолжительных однократных физических нагрузок наблюдаются
сходные изменения микроциркуляторного русла в обеих частях железы. В ацинарном
отделе коэффициент кровоснабжения возрастает на 21,6% за счет повышения
активности ЩФ на 15,6% и небольшого
увеличения объема капилляров на 5,7% (рис.2а). Коэффициент кровоснабжения
эндокринной части превышает контрольные значения на 44,9% за счет выраженного
подъема показателей оптической плотности ЩФ на 30,9% и объема капилляров на
11,7% (рис.2б). Для сосудов
терминального русла обеих частей железы характерно появление извилистости и
неровности контуров, локальные расширения, переполнение их форменными
элементами. В капиллярах отмечается агрегация эритроцитов, в некоторых участках
видны небольшие плазморагии. Морфометрически просвет капилляров в экзокринной
части железы больше на 4,6%, а в эндокринной части на 5,3% значений контрольной
группы. На электронномикроскопическом уровне в эндотелии капилляров ацинарной
части выявляется утолщение и разрыхление базального слоя, набухание
эндотелиальных клеток. Поверхность клеток, обращенная в просвет капилляра,
имеет неровный контур и образует небольшие цитоплазматические отростки,
отмечено увеличение пиноцитозных пузырьков (рис.3). В эндокринной части во
многих эндотелиальных клетках ядро повышенной осмиофильности с конденсацией
хроматина вблизи оболочки и в виде глыбок в центре. Контуры ядра достаточно
ровные, у части клеток появляются выпячивания в связи с увеличением поверхности
ядра. В цитоплазме обнаруживались мелкие вакуоли, большее количество
пиноцитозных пузырьков, рибосом (рис.4). Выявленные изменения можно расценивать
как признаки усиления функциональной активности капилляров в ответ на
непродолжительную физическую нагрузку. В то же время необходимо учитывать, что
данные получены у животных с нарушенной толерантностью к глюкозе, где одной из
причин реактивности капиллярного русла является нарушение углеводного
гомеостаза. По мнению ряда авторов при инсулинорезистентности и нарушении
толерантности к глюкозе внеклеточное накопление глюкозы, липидов, белков, ионов
кальция приводит к неферментному гликолизированию мембраны сосудов, появлению
липидосодержащих комплексов и белков во внеклеточном пространстве, дистрофии
окружающих сосудов, что ведет к полнокровию, нарушению микроциркуляции,
интерстициальному отеку [10, 11]. В проводимых ранее исследованиях отмечались
морфометрические и структурные преобразования в системе микроциркуляции в ответ
на непродолжительную физическую нагрузку у животных с нормальной толерантностью
к глюкозе, которые не имели принципиальных отличий от ныне полученных, но были
менее выражены [12]. Это дает основание расценивать выявленные изменения как
компенсаторно-приспособительные и не приводящие к выраженному нарушению
функционирования сосудов терминального русла.
Литература.
1.
Худайбердиев
Р.И., Хидоятов Б.А., Юнусходжаев П.Ю. Микрососудистое русло поджелудочной
железы. Морфология 1994;1-3: 115 -124.
2. Банин В.В. Механизмы
обмена внутренней среды. М: Изд-во РГМУ; 2000; 276 с.
3.
Marshall
S.M., Flyvbjerg A. Prevention and early detection of vascular complications of
diabetes. BMJ 2006; 2:475-480.
4. Черданцев Д.В., Николаева Л.П., Степаненко А.В., Константинов Е.П.
Патогенетическая роль диабетической макроангиопатии, возможные варианты
коррекции. Современные проблемы науки и образования 2010; 1: 53-57.
5. Лебедева В. М. Диабет. Современный взгляд на лечение и профилактику. СПб: ИГ «Весь»;
2005; 192с.
6.
Bogardus
C., Ravussin E., Robbins D.C. et al. Effect of physical training and diet therapy on carbohydrate metabolism
in patients with glucose intolerance and NIDD mellitus. Diabetes 1984; 33: 311-318.
7. Caro F. Insulin resistance in obese and nonobese man. J. Clin. Endocrinol. Metab. 1991; 73: 691-695.
8. Быков В.Л. Метод
комплексного морфо-функционального изучения капиллярного русла щитовидной
железы. Архив Анатомии 1975; 5: 41-43.
9.
Кочетков
А.Г., Силин Е.В., Савельев В.Е.и др. Система морфометрического анализа
изображения МАКС-1000 в медико-биологических исследованиях. Нижегородский мед.
журнал1999; 1: 54-57.
10. De Fronzo. New aspects of pathological genesis the diabetes mellitus. Diabetes 1998; l.37: 667-678.
11. Ignarro L.J., Wei Lun. Visiting Professorial Lecture: Nitric oxide in the regulation in vascular function: an historical overview. J Card surg 2002 Jul-Aug; 17(4): 301-306.
12. Никонова Л.Г. Изменения
компонентов микроциркуляторного русла островковой части поджелудочной железы
при воздействии двигательных нагрузок различной интенсивности. Морфологические
ведомости 2007; 1-2: 98-101
|
а |
б |
Рис.
1. Распределение фермента ЩФ в стенке капилляров ацинарной (а) и островковой
(б)
частей поджелудочной железы у животных с нарушенной толерантностью к глюкозе
контрольной группы.
|
а |
б |
Рис.
2. Сравнительная характеристика показателей микроциркуляторного русла
экзокринной (а) и эндокринной (б) частей поджелудочной железы у животных с
нарушенной толерантностью к глюкозе.
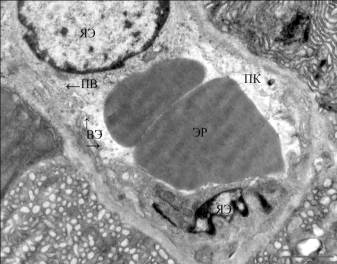
Рис.3.
Капилляр ацинарной части поджелудочной железы у животных с нарушенной
толерантностью к глюкозе после воздействия непродолжительной физической
нагрузки ( Эр-эритроцит, ПВ –пиноцитозные везикулы, ПК – просвет капилляра, ВЭ
–цитоплазматические выросты, ЯЭ – ядро эндотелиоцита).
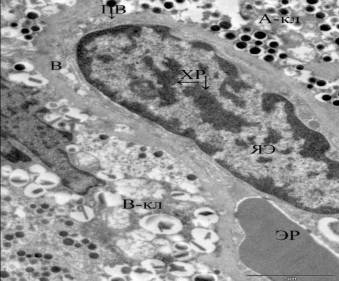
Рис.4.
Капилляр островковой части поджелудочной железы у животных с нарушенной
толерантностью к глюкозе после воздействия непродолжительной физической
нагрузки (ЭР– эритроцит, ЯЭ- ядро эндотелиоцита, ХР – скопления хроматина,
В-вакуоли, ПВ – пиноцитозные везикулы, А-кл – глюкагоноцит, В-кл –
инсулиноцит).