К.х.н. Перевозкина М.Г.
ФГБОУ ВПО «Государственный
аграрный университет Северного
Зауралья», Россия
КАТАЛИТИЧЕСКОЕ
ОКИСЛЕНИЕ ЛИПИДОВ В ВОДНО-ЭМУЛЬСИОННЫХ РАСТВОРАХ В ПРИСУТСТВИИ СОЛЕЙ МЕТАЛЛОВ
ПЕРЕМЕННОЙ ВАЛЕНТНОСТИ
(Cu2+, Co2+, Fe2+, Fe3+, Ni2+)
АННОТАЦИЯ
Разработана кинетическая модель
экспресс-тестирования антиоксидантной активности различных классов органических
соединений (фенолов,
аминов, серосодержащих соединений) в
условиях, приближенных к биологическим средам. Показано, что скорость окисления
модельных липидов в водно-эмульсионной среде в 1000 раз выше, чем в безводной
среде. Подобраны оптимальные условия каталитического окисления эфиров высших
ненасыщенных жирных кислот в водно-эмульсионной среде в зависимости от природы
и концентрации солей металлов переменной валентности и поверхностно-активного
вещества. В основу разработки легло
представление о том, что в клетке процессы протекают с высокими скоростями,
антиоксиданты действуют в водно-липидном окружении. В качестве способа
максимального ускорения процесса окисления выбран металлокатализ. Из катионов
металлов отобран наиболее эффективный катализатор – хлорид меди (II) в
концентрации 2´10-3 М.
Ключевые
слова: каталитическое окисление
липидов, экспресс-тестирование антиоксидантной активности, пероксидное
окисление, соли металлов переменной валентности, мицеллы, водно-эмульсионная
среда.
SUMMARY
The kinetic model of rapid testing antioxidant activity of different
classes of organic compounds in conditions similar to the conditions of the
biological environment. The rate of oxidation of lipids in model water-emulsion
medium is 1000 times higher than in non-aqueous medium. Optimal conditions of
catalytic oxidation of unsaturated esters of higher fatty acids in aqueous
emulsion medium, depending on the nature and concentration of salts of
transition metals valence and surfactant.
In a basis of development formed the view
that in the cell processes are very high velocities, antioxidants act in
water-lipid environment. As the method of maximum acceleration of the process
of oxidation is selected catalysis by metals. Of cations of metals selected the
most effective catalyst - chloride and copper (II) at a concentration of 2´10-3 М.
Keywords: catalytic oxidation of lipids, rapid testing antioxidant activity,
lipid oxidation, salts of metals of variable valency, micelles, water-emulsion
environment.
Известно, что
катионы металлов входят в структуру биокластеров, активных центров
многочисленных белков-ферментов. Так, железо входит в состав гемоглобина,
цитохромов, каталазы, содержится в ферритине, трансферрине. Кобальт входит в
состав цианокобаламина (витамина В12), его аналоги являются
кофакторами различных ферментов, участвующих в эритропоэзе. Медь содержится в
цитохроме-С-оксидазе, в голубых белках, супероксиддисмутазе [1].
Особенности
окисления липидов в клетке обусловлены, прежде всего, каталитической
активностью катионов металлов и возможностью участия ферментов в регулировании
этих процессов. Известны многочисленные работы по тестированию активности
катионов металлов, которые относятся, в основном, к катализу гомогенных
липидных систем [2,3,4,5]. Эти результаты имеют ограниченное значение для
описания процессов окисления, протекающих в мицеллах и живой клетке.
Целью настоящей
работы является изучение каталитического влияния солей ряда металлов (хлорида железа (III), сульфата железа (II),
хлорида никеля (II), хлорида кобальта (II), хлорида меди (II)) на
процесс окисления липидного субстрата в водно-эмульсионной среде (ВЭС),
приближенной к условиям клетки. Решались следующие задачи: подобрать
оптимальные условия каталитического окисления эфиров высших ненасыщенных кислот
в ВЭС в зависимости от природы и концентрации солей переходных металлов и
поверхностно-активного вещества (ПАВ), показать перспективность использования
гетерогенной системы в качестве модели для изучения окисления субстратов разной
природы в присутствии антиоксидантов (АО).
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве
липидного субстрата использовали метиллинолеат (МЛ), полученый методом
этерификации линолевой кислоты метанолом в кислой среде с последующей
перегонкой эфира под вакуумом. Процесс окисления липидного субстрата в ВЭС
проводили в модернизированной установке [6], предназначенной для процессов,
протекающих с большими скоростями (»10-4 М´с-1) и
поглощающих наибольший объем кислорода (до 25 дм3). Окисление проводили в
присутствии триметилцетиламмоний бромида (ЦТМАБ) в качестве
поверхностно-активного вещества (10-4–10-2 М), с
добавками растворов солей металлов в количестве (10-6-10-1 М)
при t=(60±0,2)0С. Соотношение воды и липидов составляло 3:1, а
общий объем пробы 4 мл. Критическую
концентрацию мицеллообразования (ККМ) ЦТМАБ изучали методом Ребиндера и рефрактометрическим
методом.
РЕЗУЛЬТАТЫ
И ОБСУЖДЕНИЕ
Механизм действия катализатора при окисления субстрата может быть охарактеризован по характеру кинетических кривых (КК). При участии катионов металлов только в зарождении цепей процесс окисления должен начинаться и протекать с постоянной скоростью. Если катализатор участвует в зарождение цепей и распаде гидропероксидов, то кинетика должна быть более сложной: КК должны содержать прямолинейный начальный участок, который соответствует только участию катионов в зарождении цепей и накоплению необходимых концентраций гидропероксилов. При достижении критических концентраций гидропероксидов начинается их распад с участием катионов, ускорение процесса и достижение максимальной скорости. Конкурентное участие катионов в обрыве цепей должно приводить к замедлению процесса и S-образному характеру КК. Замедление процесса возможно также за счет перехода катиона металла в менее активную форму.
В присутствии
катализатора известны следующие реакции зарождения цепей [1]:
RH + Cu2+ ¾® R● + Cu1+ + H+
ROOH + Cu1+ ¾® RO● + OH● + Cu2+
ROOH + Cu2+ ¾® RO2● + H+ + Cu1+
Возможно участие
катализатора в продолжении цепей :
RO2● + Cu2++ H2O ¾® RO● + Cu( OH )2
RO● + RH ¾® R● + ROOH
Исследовали
в качестве катализатора соли железа (II,III), исходя из того, что железо в
свободном состоянии и в виде комплексов является естественным катализатором
процессов ПОЛ в живой клетке организма [1].
На рис. 1 приведены кинетические кривые поглощения кислорода МЛ в присутствии различных концентраций хлорида железа. Из рис.1. видно, что кривые имеют классическую S-образную форму. На кривых можно различить два участка. Первый участок характеризует аутоускоренный процесс, выход реакции на максимальную стационарную скорость, второй – замедление и достижение предельной скорости. Кинетические параметры окисления приведены в табл. 1. Как видно из таблицы, при всех концентрациях хлорида железа (III) начальные (Wнач.) и максимальные (Wмах.) скорости окисления меняются в незначительных пределах и составляют ( 2,7 ± 0,4 )×10-5 и ( 4,3 ± 0,8 )×10-5 М × с-1.
В соответствии с общей концепцией механизма катализа, результаты могут быть объяснены следующим образом: начальный участок КК характеризует процесс медленного накопления радикалов за счет участия катализатора в реакциях зарождения цепей. Второй участок - характеризует процесс накопления гидропероксидов, катализатор участвует в разветвлении цепей за счет их радикального распада. При этом скорость достигает максимального значения. По мере накопления гидропероксидов или других продуктов окисления образуются их комплексы с катионами железа, которые распадаются затем по молекулярному механизму. На этом участке кривой появляется ингибирующая активность катализатора, при этом скорость окисления значительно снижается.
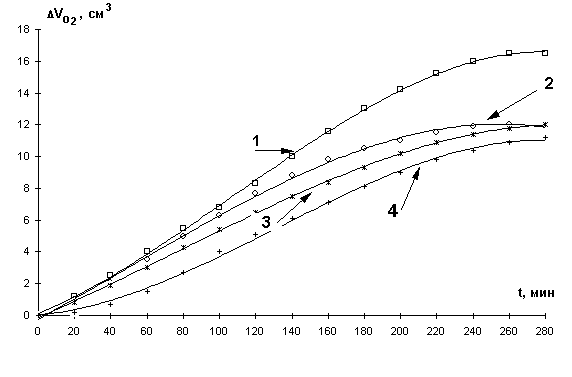
Рис. 1.
Кинетические кривые окисления МЛ в водно-эмульсионной среде в присутствии
добавок хлорида железа (III): 1- 1´10-2 М; 2- 1´10-1 М;3- 1´10-4 М; 4- 1´10-3 М, 1×10-3 М ЦТМАБ, t=60° С.
При окислении МЛ в
зависимости от концентрации добавок сульфата железа (II) наблюдали два характера
кинетических кривых при разных концентрациях катализатора (рис.2). Первая
зависимость характеризует аутоускоренный процесс на всем протяжении
кинетической кривой (при соотношении катализатора и субстрата 1 : 100000 – 1 :
500 ). Второй вид КК имеет два участка (при соотношении катализатора и
субстрата 1 : 50 – 1 : 1). Первый участок - аутоускоренный процесс, где
поглощается небольшой объем кислорода (2,7 – 3,1) × 10-4 М, второй -
замедление, а затем достижение предельной скорости (при поглощении ( 5,6 – 6,3
) × 10-4 М кислорода ).
Приведенные данные свидетельствуют об участии катионов железа ( II ) в реакциях зарождения цепей, в радикальном распаде гидропероксидов, что соответствует аутоускоренному характеру КК. При S-образном характере КК возможно образование комплексов продуктов окисления с катионами железа (II). При этом молекулярный распад комплексов приводит к снижению скорости окисления. На этом участке кривой проявляется ингибирующая активность катализатора и скорость снижается.
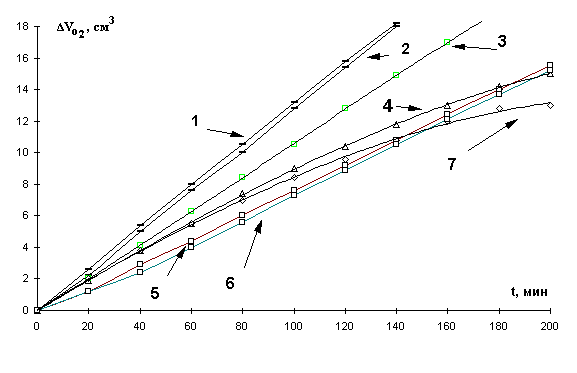 Рис. 2. Кинетические кривые
окисления в водно-эмульсионной среде МЛ в присутствии добавок сульфата железа (II), М:
1- 1×10-4, 2- 2×10-4, 3- 1×10-5,
4- 1×10-2, 5- 5×10-4, 6- 1×10-6,
7- 1×10-3, 1×10-3 М ЦТМАБ, t=60° С.
Рис. 2. Кинетические кривые
окисления в водно-эмульсионной среде МЛ в присутствии добавок сульфата железа (II), М:
1- 1×10-4, 2- 2×10-4, 3- 1×10-5,
4- 1×10-2, 5- 5×10-4, 6- 1×10-6,
7- 1×10-3, 1×10-3 М ЦТМАБ, t=60° С.
Исследована кинетика
окисления МЛ в зависимости от концентрации хлорида никеля (II). Показано, что
при всех исследуемых концентрациях КК окисления имеют S-образный характер (рис. 3). Начальный
участок КК характеризует процесс медленного накопления радикалов за счет
участия катализатора в реакциях зарождения цепей, второй участок – процесс
накопления гидропероксидов и участия катализатора в разветвлении цепей.
КК окисления МЛ в присутствии хлорида кобальта (II) и хлорида меди (II) имеют аутоускоренный характер (рис. 4, рис. 5). Характер КК может быть обусловлен участием катализатора в реакциях зарождения и разветвления цепей. С увеличением концентрации катализатора (хлорида кобальта (II) до 1×10-2 М, хлорида меди (II) до 1×10-3 М) увеличивается максимальная скорость окисления, которая в дальнейшем с повышением концентрации катализатора снижается. При концентрации хлорида меди (II) (1-2)×10-3 М сокращается период аутоускорения и процесс начинается с максимальной скорости.
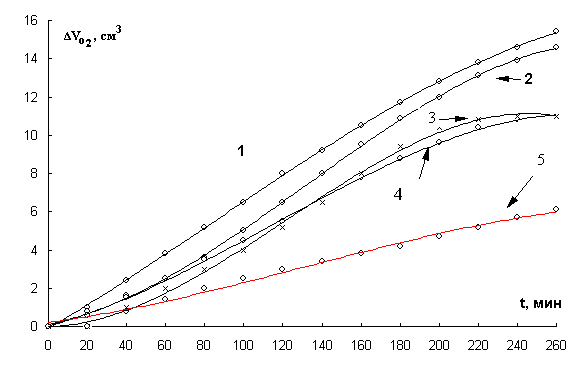
Рис. 3. Кинетические кривые окисления в водно-эмульсионной
среде МЛ в присутствии добавок хлорида
никеля ( II ), М : 1- 7×10-3, 2- 5×10-2,
3- 1×10-1, 4- 7×10-4,
5- 2×10-4, 1×10-3 М ЦТМАБ, t=60° С.
С целью выбора наиболее эффективного катализатора изучали в сравнительном аспекте влияние упомянутых выше солей на процесс окисления МЛ. На рис. 6. представлены КК поглощения кислорода в присутствии равных добавок (1´10-3 М) солей железа (II,III), никеля (II), кобальта (II) и меди (II).
Из рис.6 видно,
что в сравнимых концентрациях наиболее эффективным катализатором является хлорид
меди (II). Для него отмечается наибольшая скорость процесса, оцениваемая из
наклона КК (табл.1). При сопоставлении абсолютных значений Wмах исследуемые катализаторы
располагаются в следующем порядке: NiCl2 < FeCl3 < Fe2SO4 < CoCl2 < CuCl2.
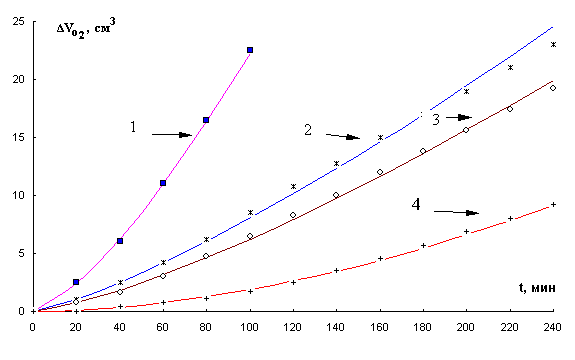
Рис. 4. Кинетические кривые окисления в
водно-эмульсионной среде МЛ в присутствии добавок хлорида кобальта ( II ), М : 1- 1×10-2,
2- 1×10-1, 3- 1×10-3,
4- 2×10-4, 1×10-3 М ЦТМАБ, t=60° С.
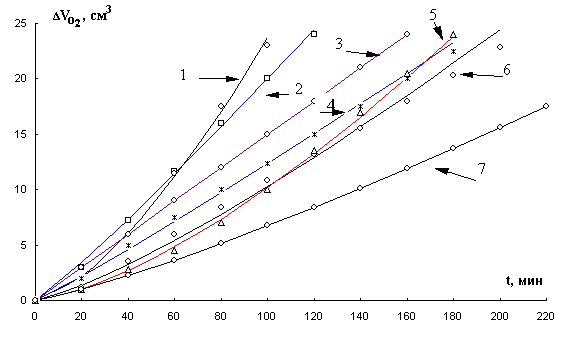
Рис. 5. Кинетические кривые окисления в
водно-эмульсионной среде МЛ в присутствии добавок хлорида меди ( II ), М : 1- 2×10-3,
2- 1×10-3, 3- 1×10-1,
4- 1×10-5, 5- 1×10-4,
6- 1×10-2, 7- 1×10-6, 1×10-3 М ЦТМАБ, t=60° С.
 Рис. 6. Кинетика окисления МЛ в водно-эмульсионной среде в присутствии
добавок солей металлов в концентрации 1×10-3 моль/дм3
: 1 - CuCl2, 2- FeSO4, 3- CoCl2, 4- FeCl3, 5- NiCl2, 1×10-3 М ЦТМАБ, t=60° С.
Рис. 6. Кинетика окисления МЛ в водно-эмульсионной среде в присутствии
добавок солей металлов в концентрации 1×10-3 моль/дм3
: 1 - CuCl2, 2- FeSO4, 3- CoCl2, 4- FeCl3, 5- NiCl2, 1×10-3 М ЦТМАБ, t=60° С.
Действие упомянутых выше солей было
изучено в широком диапазоне концентраций для отбора среди них наиболее
эффективных катализаторов. На рис. 7. приведены закономерности изменения
максимальной скорости процесса от концентрации катализатора. Можно видеть, что
концентрационные зависимости для всех веществ носят экстремальный характер,
экстремумы проявляются в разных диапазонах.
Скорости
окисления липидных субстратов в присутствии солей NiCl2 и FeCl3 выходят на максимум при
концентрациях 1,0×10-3 М, далее с ростом концентрации их
значение не меняется и составляет (4,0±0,2)×10-5 М×с-1
и (5,0±0,3)×10-5М×с-1 соответственно.
Максимальная скорость при окислении с добавками сульфата железа отмечается в
диапазоне (0,1-1,0) М и составляет (9,4±0,4)×10-5 М×с-1,
при дальнейшем росте концентрации – остается постоянной и составляет
(6,0±0,2)×10-5 М×с-1. Зависимость Wmax систем с добавками хлорида кобальта имеет ″пик″ при
концентрации (9-11)×10-3 М, при которой ее величина составляет
(24,4±0,4)×10-5 М×с-1. Хлорид меди по своим
каталитическим свойствам выделяется среди всех исследуемых веществ. Скорость
окисления в присутствии хлорида меди
выше в 5 раз, чем в присутствии других солей металлов переменной
валентности и при концентрации 2×10-3 М составляет (26,3±0,3)×10-5
М×с-1 (табл.1).
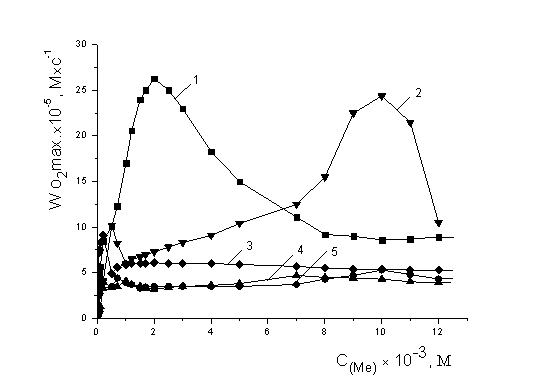 Рис. 7. Зависимость
стационарных скоростей окисления МЛ в присутствии солей катализаторов от их
концентрации, М:1 – NiCl2, 2- FeCl3, 3-Fe2SO4, 4-CoCl2, 5-CuCl2, 1×10-3 М ЦТМАБ ,t=600 С.
Рис. 7. Зависимость
стационарных скоростей окисления МЛ в присутствии солей катализаторов от их
концентрации, М:1 – NiCl2, 2- FeCl3, 3-Fe2SO4, 4-CoCl2, 5-CuCl2, 1×10-3 М ЦТМАБ ,t=600 С.
Ранее
каталитическое действие металлов переменной валентности изучалось при окислении
растительных масел, модельных липидных субстратов [ 1,2,3,4,5 ]. Был получен
ряд каталитической активности катионов:
Cu2+ > Mn2+ > Fe2+ > Cr2+ > Ni2+ >> Zn2+
Как видно из приведенных выше данных
изученные соли вписываются в указанный ряд активности металлов, а хлорид меди
обладает наибольшей каталитической активностью при наименьшей концентрации 2´10-3 М.
Таблица 1
Кинетические параметры окисления метиллинолеата в присутствии металлов
переменной валентности, t= 600С, С ЦТМАБ = 1´10-3 М, вода : липиды - 3:1.
|
[ Kat ], М |
[Kat] /
[ МЛ] |
W нач.
×10-5, М´с-1 |
W max. ×10-5, М´с-1 |
|
I Хлорид железа (III) |
|||
|
1×10-4 |
1 : 1000 |
2,7 |
3,7 |
|
2×10-4 |
1 : 500 |
3,1 |
6,5 |
|
5×10-4 |
1 : 200 |
3,0 |
3,6 |
|
7×10-4 |
1 : 135 |
3,0 |
4,4 |
|
1×10-3 |
1 : 100 |
2,3 |
3,2 |
|
2×10-3 |
1 : 50 |
1,7 |
3,5 |
|
5×10-3 |
1 : 20 |
1,7 |
3,5 |
|
1×10-2 |
1 : 10 |
3,0 |
5,3 |
|
5×10-2 |
1 : 2 |
2,0 |
3,9 |
|
1×10-1 |
1 : 1 |
3,0 |
4,9 |
|
II Сульфат железа (II) |
|||
|
1×10-6 |
1 : 100000 |
3,1 |
5,1 |
|
5×10-6 |
1 : 20000 |
3,4 |
5,7 |
|
1×10-5 |
1 : 10000 |
7,6 |
6,6 |
|
5×10-5 |
1 : 2000 |
3,8 |
7,2 |
|
1×10-4 |
1 : 1000 |
8,5 |
8,3 |
|
2×10-4 |
1 : 500 |
6,2 |
9,1 |
|
5×10-4 |
1 : 200 |
3,8 |
4,9 |
|
1×10-3 |
1 : 100 |
6,8 |
5,9 |
|
2×10-3 |
1 : 50 |
6,8 |
6,1 |
|
1×10-2 |
1 : 10 |
6,8 |
5,4 |
|
1×10-1 |
1 : 1 |
6,8 |
5,7 |
|
III Хлорид
никеля (II) |
|||
|
1×10-4 |
1 : 1000 |
1,3 |
3,1 |
|
2×10-4 |
1 : 500 |
1,4 |
3,3 |
|
7×10-4 |
1 : 140 |
3,4 |
3,5 |
|
1×10-3 |
1 : 100 |
3,5 |
4,1 |
|
2×10-3 |
1 : 50 |
2,4 |
3,2 |
|
3×10-3 |
1 : 33 |
2,4 |
3,2 |
|
5×10-3 |
1 : 20 |
2,3 |
3,8 |
|
7×10-3 |
1 : 14 |
3,0 |
4,7 |
|
1×10-2 |
1 : 10 |
2,4 |
4,3 |
|
3×10-2 |
1 : 3,3 |
1,6 |
3,9 |
|
5×10-2 |
1 : 2 |
2,2 |
4,6 |
|
1×10-1 |
1 : 1 |
1,7 |
4,7 |
|
2×10-1 |
1 : 0,5 |
3,0 |
4,4 |
|
IV Хлорид
кобальта (II) |
|||
|
1×10-4 |
1 : 1000 |
10,0 |
4,2 |
|
2×10-4 |
1 : 500 |
9,1 |
4,1 |
|
5×10-4 |
1 : 200 |
3,2 |
10,2 |
|
1×10-3 |
1 : 100 |
11,4 |
6,8 |
|
2×10-3 |
1 : 50 |
14,2 |
7,3 |
|
5×10-3 |
1 : 20 |
2,3 |
10,4 |
|
8×10-3 |
1 : 12,5 |
5,6 |
15,5 |
|
1×10-2 |
1 : 10 |
5,7 |
24,4 |
|
1,2×10-2 |
1 : 8 |
3,4 |
10,5 |
|
5×10-2 |
1 : 2 |
14,3 |
4,5 |
|
6×10-2 |
1 : 1,7 |
8,5 |
11,4 |
|
1×10-1 |
1 : 1 |
5,7 |
7,4 |
|
V Хлорид меди (II) |
|||
|
1×10-6 |
1 : 100000 |
3,5 |
9,6 |
|
1×10-5 |
1 : 10000 |
5,7 |
4,3 |
|
1×10-4 |
1 : 1000 |
3,7 |
5,7 |
|
1×10-3 |
1 : 100 |
8,6 |
14,5 |
|
2×10-3 |
1 : 50 |
14,4 |
26,3 |
|
4×10-3 |
1 : 25 |
14,3 |
18,1 |
|
5×10-3 |
1 : 20 |
13,7 |
15,0 |
|
1×10-2 |
1 : 10 |
12,8 |
8,6 |
|
2×10-2 |
1 : 5 |
11,3 |
8,9 |
|
5×10-2 |
1 : 2 |
5,7 |
15,4 |
|
1×10-1 |
1 : 1 |
8,5 |
14,5 |
Следующим этапом
создания модели для тестирования биоантиоксидантов был выбор концентрации ПАВ.
Известно [7], что скорость окисления в гомогенных системах ниже, чем в
эмульсиях и зависит от степени ее дисперсности. В работе [1] установлено, что
соотношение констант скорости роста и обрыва цепи при инициированном окисление
кумола в эмульсиях и гомогенной системе соотносится как 5,5:1 и равно 110
и 20 соответственно.
В нашем
эксперименте было установлено, что скорость окисления МЛ в водно-эмульсионной
среде в 1000 раз выше, чем в безводной.
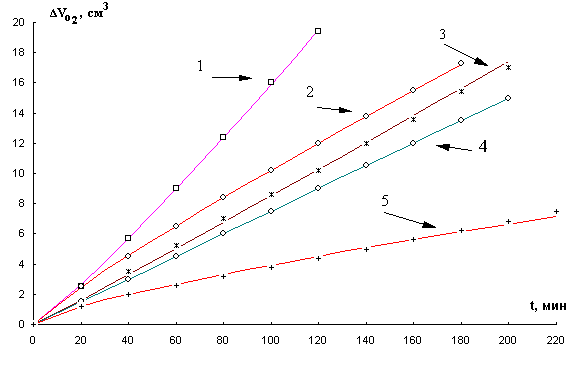
Рис. 8. Кинетика окисления МЛ в
водно-эмульсионной среде в присутствии 2×10-3 М CuCl2 и добавок
ЦТМАБ, М : 1- 1×10-3, 2- 5×10-4,
3- 5×10-3, 4- 1×10-2,
5- 1×10-4, t=600 С.
При выборе
оптимальной добавки ЦТМАБ исследовали диапазон
концентраций (10-4 - 10-2 ) М. Результаты приведены
на рис. 8. При анализе наклонов КК можно видеть, что с ростом концентраций ПАВ
скорость процесса проходит через максимум, соответствующий концентрации 1
× 10-3 М. Дальнейшее повышение
концентрации ПАВ приводит к снижению скорости окисления. Указанную концентрацию детергента, обеспечивающую
наибольшую скорость реакции, можно рекомендовать для использования в
гетерогенных моделях окисления. Методами Ребиндера и рефрактометрическим была
определена критическая концентрация мицеллообразования ЦТМАБ (1,0±0,2) ×
10-3 М, что соответствовало кинетическим данным.
Механизм
каталитического окисления углеводородов (липидов) в водно-эмульсионной среде
сводится к следующему. В присутствии ЦТМАБ формируются мицеллы.
Добавки катионного ПАВ усиливают мицеллообразование, при этом катионы
внедряются в промежутки между углеводородными «хвостами» с образованием двойного электрического слоя
[7]. С выработкой свободных радикалов высших жирных кислот катионы катализатора
должны иметь доступ к гидрофобным хвостам субстрата. При низких концентрациях
катионы имеют большую вероятность донорно-акцепторного взаимодействия с
эфирными группами субстрата, приводящего к образованию в присутствии катализатора свободных радикалов по реакции:
Me(n+1)+ + RH + O2 ¾® Men+ + R●
+ HO2●
Вероятно,
существуют оптимальные концентрации ЦТМАБ, при которых количество
контактов катионов катализатора, сложного эфира и кислорода максимально. При
увеличении концентрации ПАВ количество катионов на поверхности мицеллы
возрастает, происходит их более интенсивное отталкивание, приводящее к снижению
скорости зарождения цепей, следовательно, и скорости процесса.
В соответствии с
приведенной гипотезой добавки 1×10-3 М ЦТМАБ, являются оптимальными,
обеспечивающими максимальный контакт катионов меди и кислорода с
жирно-кислотными радикалами. Увеличение концентрации ЦТМАБ снижает количество таких контактов и скорость процесса соответственно.
Механизм
действия металлов связывают с каталитическим разрушением гидропероксидов [1] в
соответствии с реакциями:
ROOH + Fe3+ ¾® RO2● +
H+ + Fe2+
ROOH + Fe2+ ¾® RO● + H+
+ Fe3+
ROOH + Cu2+ ¾® RO2● +
H+ + Cu1+
Образующиеся при этом алкоксильные и пероксильные радикалы участвуют в дальнейшем в реакциях продолжения цепей окисления. Катионы металлов могут конкурентно участвовать в обрыве цепей [1], что должно приводить к замедлению процесса на глубоких стадиях окисления. Замедление процесса возможно также за счет перехода катиона металла в менее активную форму.
Подобные закономерности
наблюдаются и при окислении этилолеата.
По
результатам исследования для тестирования антиоксидантной активности
биоантиоксидантов предложен следующий способ: 1 мл липидов смешивают с 1 мл 1×10-3 М водного раствора ЦТМАБ с 1 мл 2×10-3 М водного раствора хлорида
меди (II), добавляют 1 мл воды или раствора
исследуемого антиоксиданта, смесь перемешивают на магнитной мешалке, помещают в
термостатируемую при t=(60 ± 0,2)0С ячейку.
Пробу насыщают кислородом, соединяют с волюмометрической системой, измеряют
объем поглощенного кислорода во времени без добавок биоантиоксидантов и в
присутствии их в различных концентрациях. При известных скоростях инициирования
и оптимальных концентрациях ингибитора возможно определить антирадикальную
активность по величине параметра fkt7, по периоду
индукции (t)
суммарную антиоксидантную активность. Сравнение скоростей и характера КК
позволяет оценить механизм действия антиоксидантов.
Таким образом, результаты настоящего
исследования демонстрируют возможности новой кинетической модели, которая может
быть предложена для изучения процессов свободно-радикального окисления липидных
субстратов различного происхождения. Результаты тестирования антиоксидантной
активности различных классов органических соединений (фенолов, аминов,
серосодержащих соединений) при помощи
новой кинетической модели будут представлены в отдельной работе.
Разработанный способ тестирования
биоантиоксидантов волюмометрическим
методом с использованием каталитического окисления водно-эмульсионных липидных
субстратов был внедрен в НИИ клинической и профилактической кардиологии СО
РАМН, отдел артериальной гипертонии (Авторы внедрения: В.Н. Ушкалова, Н.В.
Иоанидис, Г.Д. Кадочникова, В.В. Тихонова, М.Г. Перевозкина).
1.
Разработана
кинетическая модель тестирования биоантиоксидантов в водно-эмульсионной
каталитической среде, выбраны оптимальные концентрации катализатора и
поверхностно-активного вещества.
2.
Установлено, что
скорость окисления модельных липидов в водно-эмульсионной среде в 1000 раз
выше, чем в безводной среде, это позволяет значительно сократить время тестирования
антиоксидантной активности соединений.
3.
Получен
ряд каталитической активности солей металлов переменной валентности: Cu2+ > Fe2+ > Fe 3+ > Co2+> Ni2+.
ЛИТЕРАТУРА
1
Владимиров Ю.А., Суслова
Т.Б., Оленев В.И. Митохондрии.
Транспорт электронов и преобразование энергии. М.: Наука, 1976. – 109 с.
2
Арутюнян Р.С., Налбандян Дж.М., Бейлерян Н.М. Инициированное окисление
кумола в водных эмульсиях // Кинетика и катализ. - 1985, - Т.26, - вып.4, - №
6, - С. 1475 - 1477.
3 Allen Y.C., Farag P. A comparison between the metal-catalysed
autoxidation of agueous emulsions of linoleic acid, trilinolein and
phospholipids 3 Symp. int. oxide lipides catalyses metaux. Paris.
- 1974. - P.
44-56.
4
Burton G.W., Ingold K.U. Autoxidation of
biological molecules. 1. The antioxidant activity of vitamin E and related
chainbreaning phenolic antioxidant in vitro // J. Amer. Chem. Soc. - 1987. - V.103.
- N 21. - P. 6472-6477.
5 Pokorny J., Luan N.T., Janicek G. Changes of to copherols in vegetable
oils under the conditiong of deep fat frying // Sb. Vysoke skoly chemicko -
technologicke V Praze. - 1973. - E.39. - P. 24-41.
6 Ушкалова
В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств
антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в
эксперименте и клинике. Тюмень, Из-во Тюм.ГУ. - 1997. - С. 77-82.
7
Мицелярно - каталитическое окисление углеводородов. 1. Окисление кумола
кислородом в водных растворах додецилсульфата натрия в присутствии сульфата
меди / Л.П. Паничева, Н.Ю. Третьяков, С.А. Яковлева, А.Я. Юффа // Кинетика и
катализ. - 1990. - Т.31. - вып. 1. - С. 96-101.