Химия и химические технологии / 5. Фундаментальные проблемы создания новых материалов и технологий
*Цыба Ю.В., *Бондарев
Н.В., **Зайцева И.С.
*Национальный
университет имени В.Н. Каразина, Харьков, Украина
**Харьковская
национальная академия городского хозяйства, Украина
Регрессионно-корреляционный
и термодинамический
анализ влияния свойств
растворителей вода-метанол,
вода-этанол,
вода-пропан-2-ол на силу бензойной
кислоты
Цель работы – построение регрессионных моделей зависимости силы бензойной кислоты
от свойств смешанных водно-спиртовых растворителей и сопоставление результатов
сольватационно-термодинамического и корреляционно-регрессионного анализа термодинамики
диссоциации слабой кислоты.
Задачи исследования: сформировать базу данных по термодинамическим
константам диссоциации бензойной
кислоты в водно-органических растворителях вода-метанол, вода-этанол,
вода-пропан-2-ол в аквамоляльной концентрационной шкале; выполнить корреляционный
анализ зависимостей термодинамики диссоциации бензойной кислоты от физико-химических
параметров смешанных водно-спиртовых растворителей; предложить адекватные модели
для описания зависимости силы бензойной кислоты от состава смешанных растворителей;
оценить вклад диэлектрических, "химических" свойств и плотности
энергии когезии водно-органических растворителей на силу бензойной кислоты; сопоставить
результаты корреляционно-регрессионного и сольватационно-термодинамического
анализа влияния эффектов среды на силу слабой кислоты.
Научная
новизна: получены корреляционные уравнения, связывающие энергии Гиббса диссоциации карбоновых кислот с параметром
Димрота-Райхарда, диэлектрической проницаемостью и плотностью энергии когезии
растворителя.
Практическая значимость: полученные в работе корреляционные зависимости могут
быть использованы для прогнозирования силы карбоновых кислот и параметров их
сольватации в еще неизученных растворителях.
Наиболее значимыми факторами, определяющими зависимость энергии Гиббса диссоциации бензойной кислоты от состава смешанных растворителей, являются (табл. 1) параметр Димрота-Райхардта (ETN, электроноакцепторные свойства растворителей) и плотность энергии когезии d2N. Налицо мультиколлениарность факторов ETN и 1/eN ( –0.87 ), BKT (параметр Камлета-Тафта) и 1/eN (0,88), BKT и ETN ( –0.98 ).
Таблица 1. Корреляционная матрица
|
n=22 |
1/eN |
ETN |
BKT |
d2N |
DrGod(HBz) |
|
1/eN |
1,00000 |
-0,87438 |
0,87785 |
-0,65965 |
0,92420 |
|
ETN |
-0,87438 |
1,00000 |
-0,97735 |
0,57887 |
-0,90689 |
|
BKT |
0,87785 |
-0,97735 |
1,00000 |
-0,70820 |
0,94584 |
|
d2N |
-0,65965 |
0,57887 |
-0,70820 |
1,00000 |
-0,82687 |
|
DrGod(HBz) |
0,92420 |
-0,90689 |
0,94584 |
-0,82687 |
1,00000 |
В табл. 2. приведены результаты
множественной регрессии для зависимости
энергии Гиббса диссоциации бензойной кислоты от физико-химических свойств
смешанных водно-органических растворителей.
Таблица 2. Статистические характеристики зависимости DrGod(HBz) от свойств водно-органических
растворителей
|
|
B |
Std.Err. |
t(19) |
p-level |
|
Intercept |
67,28 |
1,66 |
40,4 |
0,000000 |
|
ETN |
-29,77 |
2,62 |
-11,4 |
0,000000 |
|
d2N |
-15,28 |
1,90 |
-8,0 |
0,000000 |
DrGod(HBz) = (67,3 ± 3,5) – (29,8 ± 5,5)·ETN – (15,3 ± 4,0)·d2N
n =22; s = 0,998; F(2,19)
= 225,2 Fкр(2,19) =3.52; tкр(19) = 2,093; r
= 0.980.
Электроноакцепторные свойства
смешанного растворителя (рис. 1), проявляемые в отношении молекул бензойной
кислоты и бензоат- ионов, как доноров электронной пары, в большей мере
способствуют уменьшению сольватации анионов кислоты, что в свою очередь снижает
силу бензойной кислоты, наряду с уменьшением плотности энергии когезии,
способствующей стабилизации молекул кислоты.
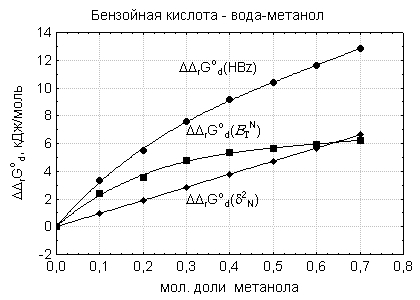
Рис.
1. Влияние плотности энергии когезии и
электроноакцепторных свойств растворителей
вода-метанол на уменьшение силы бензойной кислоты
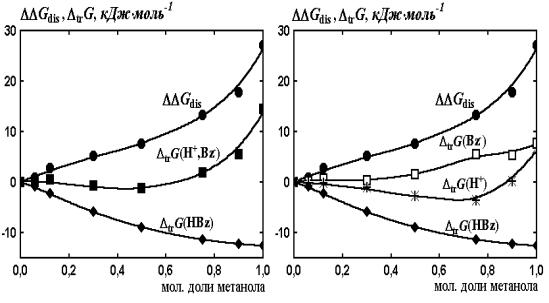
Рис.
2. Результаты
сольватационно-термодинамического анализа бензойной кислоты в водно-метанольных
растворителях
Выводы корреляционно-регрессионного анализа данных, подтверждают
результаты сольватационно-термодинамического анализа (рис. 2) – уменьшение
диссоциации бензойной кислоты в водно-метанольных растворителях по сравнению с
водой в обусловлено возрастанием сольватации молекул кислоты, в то время как
для сольватации протона и бензоат- ионов присущ компенсирующий эффект в
растворителях с мольной долей спирта до 0.8.