Химия и химические технологии/5. Фундаментальные проблемы
создания новых материалов и технологий
Боровикова Л.Н., Валуева С.В.
Федеральное государственное бюджетное учреждение
науки Институт высокомолекулярных соединений РАН, Санкт-Петербург, Россия
Спектральные характеристики селен- и селенид-
содержащих комплексов с фотодитазином
Порфирины обладают рядом ценных свойств: а) преимущественная
локализация в быстро пролиферирующих тканях, включая опухолевые
новообразования; б) флуоресценция в видимой области спектра; в)
фотодинамический эффект; д) тропность порфиринов к опухолям [1]. В настоящее
время в ряду порфиринов повышенный интерес вызывает использование производных
хлоринового ряда в качестве фотосенсибилизаторов (ФС) для фотодинамической терапии
(ФДТ) злокачественных новообразований. Одним из лучших ФС этого ряда является
фотодитазин (ФД) - ди-N-метилглюкаминовая соль хлорина е6 -
оригинальный отечественный препарат, созданный ООО «Вета-Гранд» [2]. Установлено,
что успешное применение ФДТ для лечения опухолей зависит от способности ФС
селективно накапливаться в ткани опухоли [3]. Поэтому актуальным направлением
исследований является совершенствование лекарственной формы с целью повышения
селективности накопления фотодитазина в опухоли и увеличения эффективности ФДТ.
В перспективе создания новых высокоэффективных
противоопухолевых препаратов для ФДТ были синтезированы и изучены комплексы на основе наночастиц селенида цинка (ZnSe) и
нуль-валентного селена (Se0), стабилизированных ФД. ZnSe является
одним из наиболее важных широкозонных полупроводников группы АII-BVI (диапазон пропускания 0.5-22 мкм). Наночастицы
Se0 обладают комплексом уникальных биомедицинских свойств, главным
из которых является высокая противоопухолевая активность.
Целью
работы являлось сравнительное исследование спектральных характеристик новых
комплексов на основе наночастиц ZnSe и Se0,
стабилизированных ФД. Эти системы могут служить базовой
компонентой для разработки нанотехнологии получения мультифункциональных
биологически активных наноструктур.
В работе использовались селенистая и аскорбиновая кислоты («Вектон»,
Санкт–Петербург). Вещества растворялись в апирогенной воде для инъекций,
дополнительно фильтрованной через стеклянный фильтр. Измерения оптической
плотности проводились на спектрофотометре «SPECORD M40» (Карл Цейс Йена, Германия) в диапазоне длин
волн 220-800 нм в кварцевых кюветах с толщиной фотометрического слоя 1 см..
Синтез наночастиц селена с ФД осуществлялся в результате реакции (1)
между селенистой и аскорбиновой кислотами в присутствии ФД.
H2SeO3+ 2C6H8O6
→ Se + 3H2O+ 2C6H6O6 (1)
Синтез
селенида цинка проводился гидротермальным методом при температуре 1800С
в результате реакции между ацетатом
цинка (Zn(Ac)2٠2H2O), селенидом натрия и
водным гидразином (N2H4٠H2O) (2):
Zn2+ + SeO32- + N2H4OH
→ ZnSe + H2O +
NH3 + 3O2- + N3+ (2)
Для получения комплекса ZnSe/ФД в остывший раствор селенида цинка вводили ФД.
Абсорбционный
спектр водных растворов ФД имеет 5 полос поглощения: при λ = 280, 402,
504, 608 и 662 нм. Для спектрального анализа можно использовать все длины
волны, но наиболее информативными в нашем случае будут пики при длинах волн 662 и 402
нм (полоса Соре).
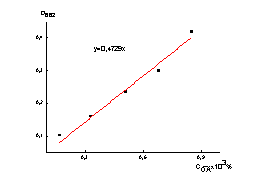
На рис.1 в качестве примера представлена
зависимость оптической плотности растворов ФД от его концентрации в диапазоне от 0.17×10-3 до 0.85×10-3 масс. % для характеристического максимума при λ = 662 нм. Эта зависимость
в выбранном диапазоне концентраций имеет линейный характер, что свидетельствует
о выполнении закона Бугера – Ламберта – Бера [4].
|
|
|
Рис. 1. Зависимость D662
от CФД |
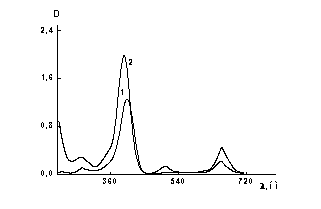
На рис. 2 показано сравнение спектров
свободного ФД и раствора ФД с ZnSe при фиксированной
концентрации ФД (сФД =0.17×10-3 масс. %). Проведенные расчеты при рассматриваемых
длинах волн величин оптического поглощения для водных растворов ФД показывают,
что наблюдаемая оптическая плотность смеси ФД и селенида цинка превышает сумму оптических плотностей отдельных
компонентов для всех характеристических максимумов ФД (селенид цинка в
исследуемой области не поглощает (рис.3,
кривая 1)). При этом сдвига максимумов поглощения не наблюдается (рис.2). Это свидетельствует о том, что
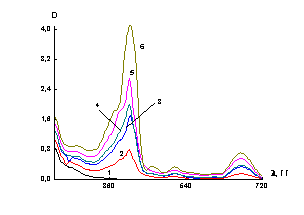
образуется комплекс ZnSe/ФД. При этом увеличение концентрации ФД в
растворе приводит к возрастанию оптической плотности поглощения пропорционально
концентрации введенного ФД (рис.3,
кривые 2-6).
|
|
|
|
Рис. 2.
Зависимость оптической плотности от длины волны: 1 – для ФД в воде (рН
=6.2, сФД =0.17×10-3 масс. %); 2 – для раствора ZnSe+ФД (рН =8.0, сФД
=0.17× 10-3 масс. %). |
Рис.3. Зависимость оптической плотности от длины волны для ZnSe в воде (1) и для растворов ZnSe+ФД
(2-6). 2 – сФД =0.17× 10-3 масс. %; 3 – сФД
=0.34×10-3 масс. %; 4 – сФД =0.51×10-3
масс. %; 5 – сФД =0.68× 10-3 масс. %; 6 – сФД
=0.85×10-3 масс. %. |
Следует
отметить, что разница оптических плотностей свободного ФД и ФД с ZnSe
значительна, особенно в области полосы Соре (λ = 402 нм). Происхождение
полосы Соре связано с пиррольными кольцами: по уширению или сдвигу этой полосы
принято считать, что идет комплексообразование по типу образования металл-
порфириновых комплексов [5]. При этом
ион металла встраивается в пиррольное кольцо ФД. В нашем случае наблюдается
уширение пика и его увеличение по амплитуде (гиперхромный эффект). Таким
образом, можно предположить, что диполь селенида цинка встраивается в
пиррольное кольцо ФД, что и отражается на изменении в полосе Соре. Относительно
интересующей нас с точки зрения ФДТ
длины волны 662 нм (рис. 4), следует отметить, что введение селенида
цинка в раствор ФД при этой длине волны также вызывает гиперхромный эффект. Это
обстоятельство можно использовать для усиления эффекта в ФДТ.
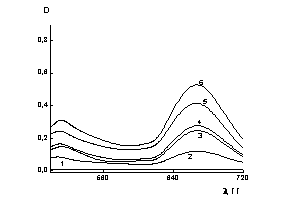
Рис.4. Зависимость оптической плотности от длины волны
для ZnSe в воде (1) и для
растворов ZnSe +ФД (2-6): 2 – сФД =0.17×10-3
масс. %; 3 – сФД =0.34×10-3 масс. %; 4 – сФД
=0.51×10-3 масс. %; 5 – сФД =0.68×10-3
масс. %; 6 – сФД =0.85×10-3 масс. %.
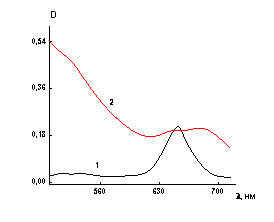
На рис. 5 показана зависимость оптической
плотности от длины волны в диапазоне λ=500-730 нм для системы Se0/ФД.
Как и в случае с селенидом цинка, для смеси ФД с селеном по сравнению со
свободным ФД наблюдается увеличение оптической плотности, что свидетельствует
об образовании комплекса Se0/ФД (в диапазоне 500-720 нм золь селена
не поглощает) (рис. 5а).
|
|
|
|
Рис.5а. Зависимость оптической плотности от длины
волны: 1 – для ФД в воде (рН =6.2, сФД =0.17×10-3
масс. %); 2 – для раствора Se+ФД
(рН =3.3, сФД =0.17× 10-3 масс. %). |
Рис.5б. Зависимость оптической плотности от длины
волны для Se в воде (1) и для
растворов Se +ФД (2-6): 2 – сФД
=0.17×10-3 масс. %; 3 – сФД =0.34×10-3
масс. %; 4 – сФД =0.51×10-3 масс. %; 5 – сФД
=0.68×10-3 масс. %; 6 – сФД=0.85×10-3
масс. %. |
При этом наиболее
интересная картина наблюдается при λ≥660 нм: помимо гиперхромного эффекта происходит смещение максимума в коротковолновую область
(λmax = 640 нм) - гипсохромный сдвиг,
кроме того, при увеличении концентрации ФД в растворе появляется плечо при λ=660-680 нм. Важно отметить, что наблюдаемое плечо становится более
выраженным при возрастании концентрации ФД в растворе. Гипсохромный сдвиг
принято относить на счет кислотности среды: в зависимости от кислотности среды
порфирин находится либо в непротонируемой форме (рН>4), либо - в протонируемой (рН<4) [6]. В нашем случае для системы ZnSe/ФД рН =
9.0, а для комплекса Se0/ФД рН=3.3. Это позволяет
предположить, что гипсохромный сдвиг в случае системы Se0/ФД связан с эффектом протонирования ФД. Макроцикл ФД, обозначенный с
учетом заряда как Н2(ФД2+),
может присоединять один или два протона за счет пирролеиновых атомов (=N-) азота [7]:
Н2(ФД2+) + H+ = Н3(ФД3+)
(I) Н3(ФД3+)
+ H+ = Н4(ФД4+) (II)
При сравнении рис. 4 и 5 также обращает
на себя внимание различное поведение
комплексов ZnSe/ФД и Se0/ФД в диапазоне длин волн λ=500-600 нм: величина оптической
плотности поглощения комплексов для системы Se0/ФД намного выше, чем с для системы ZnSe/ФД. Это также связано с
протонированием ФД в кислой среде.
Выводы:
1.
Методом
УФ/видимой-спектроскопии установлен
факт образования комплексов ZnSe/ФД и Se0/ФД, при этом наночастицы
встраиваются в пиррольное кольцо ФД.
2.
Показано,
что спектральная картина для изученных селен- и селенид-содержащих
комплексов с ФД сильно отличается как
от УФ-спектров отдельных компонентов, так и между собой.
3.
Обнаружено,
что присоединение Se0, происходящее в кислой среде,
дополнительно вызывает протонирование ФД, что отражается на спектральной
картине в диапазоне λ=500-700 нм.
4.
Полученные комплексы перспективны для
создания на их основе фоточувствительных соединений для ФДТ в онкологии.
Литература:
1.
Порфирины:
спектроскопия, электрохимия, применение. Под. ред. академика Ениколопяна Н.С.
М.: Наука, 1987. 233 с.
2.
Пономарев
Г.В. и др. Способ получения хлорина e6 (RU 2330037). 2006.
3.
Kim H., Luo
Y., Li G., Kessel D.
Enhanced apoptotic response to photodynamic
therapy after bcl-2 transfection// Cancer Res.
1999. T. 59. P. 3429--3432.
4.
Маракулина
К.М., Крамор Р.В., Луканина Ю.К., Козлов М.В., Шишкина Л.Н. Использование методов УФ- и ИК- спектроскопии
для исследования комплексообразования
молекул сфингомиелина с фенольными антиоксидантами// Вестник Моск. ун-та. Сер.
2. Химия. 2012.Т.53. №4. С. 261-268.
5.
Порфирины:
структура, свойства, синтез. Под. ред. академика Ениколопяна Н.С. М.: Наука,
1985.175 с.
6.
Кропачева
Т.Н., Аминова Г.В., Корнев В.И. Влияние поверхностно – активных веществ на кислотно-основные
и комплексообразущие свойства катионного водорастворимого порфирина//Вестник
удмурдского университета. Физика.
Химия. 2011. вып. 2. С.
51-59.
7.
Hambright P.
Chemistry of water soluble porphyrins. The Pophyrin Handbook/ ed. K.M. Kadish,
K.M. Smith, R. Guilard Academic Press: San Diego. 2000. V. 3. P. 129-206.