Панасюк А.Г.
Украинский государственный химико-технологический университет, г.Днепропетровск.
Синтез и комплексообразующие свойства бензимидазолсодержащих тиосемикарбазидов
Гетероциклические
соединения, содержащие бензимидазольный фрагмент, и комплексы ряда d-металлов на их основе представляют
интерес с точки зрения их многофункциональности. Среди них найдены химические
средства защиты растений и потенциальные химфармпрепараты [1,2]; N-замещенные амиды
бензимидазол-2-тиокарбоновой кислоты образуют устойчивые комплексные соединения
различного состава и строения с солями Cu [3-5]. Последние являются, в
частности, потенциальными высокоэффективными антифрикционными и
противоизносными присадками к индустриальным маслам [6,7] и ароматическим
полиамидам [8]. Подобными свойствами могут обладать и хелаты на основе азометиновых
производных 1-амино-2-имино(тио)-3-алкилбензимидазола [9]. С другой стороны,
сохраняется интерес к комплексным соединениям 3d-металлов с тиосемикарбазидом и его
производными [10].
В связи с вышеизложенным,
нами синтезированы в 5 стадий 4-арил(алкил)-1-(бензимидазолил-21)тиосемикарбазиды:
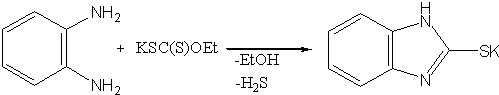
1) Взаимодействием о-фенилендиамина с этилксантогенатом калия получена калиевая соль 2-меркаптобензимидазола:
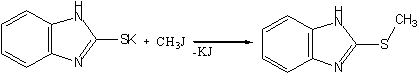
2)Метилированием К-соли получен соответствующий 2-метилмеркаптобензимидазол:
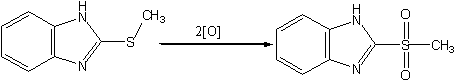
3)Окислением сульфида перманганатом калия аналогично [11] получен соответствующий сульфон:
4)Действием избытка гидразингидрата на сульфон синтезирован 2-гидразинобензимидазол:
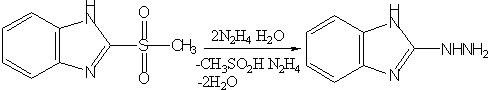
5)Взаимодействием гетарилгидразина с арил(алкил)изотиоцианатами синтезированы соответствующие тиосемикарбазиды:
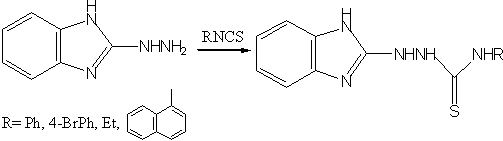
Состав и строение полученных соединений и интермедиатов доказывали методами элементного анализа, ПМР– и ИК–спектроскопии.
Комплексообразующие свойства
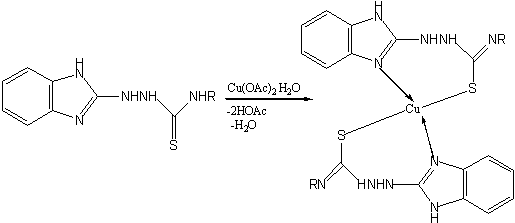
При взаимодействии
тиосемикарбaзидов с Cu(OAc)2∙Н2О
при кипячении в спиртовой среде с выходами не менее 90% аналогично описанному [12] образуются
соответствующие хелаты меди (ІІ):
Вместо ацетата можно
использовать другие соли Cu(II) слабых кислот, например, монохлорацетат, но процесс в этом
случае лучше вести в водно-спиртовой среде.
Ранее нами [13] был получен смешаннолигандный комплекс Cu(IIІ) на основе бензимидазол-2-N-(4-метоксифенил)карботиоамида и
перхлорат- аниона состава [CuL2ClO4].HClO4. В аналогичных условиях при окислении вышеописанных
хелатов CuL2
кислородом воздуха в присутствие значительного молярного избытка 69% HClO4 в кипящем безводном спирте в течение нескольких часов
были получены комплексы черного цвета по схеме:
4CuL2
+ 8HClO4+O2 = 4[CuL2 СlO4].НСlO4+2H2O
Вместо готовых хелатов можно использовать некоторые соли Cu(II) или (гидр)оксид меди(II):
4CuХ2+8HL+О2+ 8HClO4=4[CuL2 СlO4].НСlO4+8HX+2Н2О
где Х=ОАс- , СlCH2COO-, 1/2CO32-, 1/2O2-,HО-
Состав комплексных соединений был подтвержден предварительными данными элементного анализа, а строение – методом ИК–спектроскопии; кроме того, предварительные данные ЭПР–спектров смешанно-лигандных комплексов говорят в пользу их диамагнитности, т. е., по нашему мнению, получены смешаннолигандные комплексы Cu(IIІ) с координационным узлом CuN2S2O (О-атом кислорода СlO4-аниона).
Таким образом, полученные
4-арил(алкил)-1-(бензимидазолил-21)тиосемикарбазиды являются
интересными лигандами, стабилизирующими медь в разных степенях окисления.
Полученные комплексы являются потенциальными биологически активными
соединениями. Кроме того, они могут быть изучены в качестве полифункциональных
присадок к индустриальным маслам, а также
в качестве модификаторов режима горения твердых ракетных топлив. По данному вопросу см.также [14].
1. ЕПВ №9418173 МПК6 С07D 235/24/ U. Mueller, M. Sutter, A. Hubele. - №93/359. заявл. 05.02.93; опубл.
18.08.94.
2. Пат. США 4958023 МКИ7
С07D 213/52, 295/092 /Kinney W.A., Lee N.E. № 373751, заявл. 29.06.89,
опубл.18.09.90.
3. Ранский А. П. Координационные
соединения некоторых 3d-металлов с ароматическими и гетероциклическими тиоамидами.
Дисс. д.х.н. Днепропетровск, 2003. 327с.
4. Панасюк О.Г., Ранський А. П., Шебітченко Л.Н., Заведенко
Є.О. / Вопросы химии и хим. технологии. 1999. №4. С. 15 – 17.
5. Панасюк А.Г., Ранский А. П. /
Вопросы химии и хим. технологии. 2006. №3. С. 38 – 43.
6. Ранский А. П., Панасюк А.Г. /
Вопросы химии и хим. технологии. 2005. №5. С. 46 – 51.
7. Ранский А. П., Панасюк А.Г. / Вопросы химии
и хим. технологии. 2006. №4. С. 36 – 41.
8. Ситар В.І.,
Стовпник О.В., Ранський
А. П., Панасюк О.Г., Дудка
А.М. /Вопросы химии и хим. технологии. 2007. №1. С. 118 – 121.
9. И.С.Васильченко, Т.А. Кузьменко, Р.Н. Борисенко, Г.С. Бородин, И.Е.
Чикунов, А.Д. Гарновский/ Тез.докл. XXI Междунар. Чугаевской конф.
по коорд. химии. 10-13 июня 2003, Киев. С.217.
10. Т.В.Кокшарова/ Тез.докл. XXI Междунар. Чугаевской конф.
по коорд. химии. 10-13 июня 2003, Киев. С.276.
11. Гольцберг М.А., Грабалек А., Фарса О., Кребс А., Долежал П., Колдобский Г.И/ ЖОрХ.1996. Т.32.
№9.С.1415-1417.
12. Бовыкин Б.А., Романовская
Л.Г., Ранский А.П. и др. /Вопросы химии и хим. технологии.
Харьков: Вища школа. 1983. Вип. 73., С. 22 – 24.
13. Panasyuk A.G., Ranskii A.P., Aliev Z.G. /Russian J. of Coord. Chem. 2005. V. 31. №1. P. 40-44.
14. Бачурина И.В.,
Илюшин М.А, Груздев Ю.А. и др./ Мат. VIII Междунар. молод. конф. «Человек и космос». Днепропетровск, НЦАОМУ, 2006.С.372.