Литвиненко Г.С., Турмуханова М.Ж., Черных В.В.,
Шапорева Н.Ю., Горовая Е.В.
Казахский национальный университет им.аль-Фараби,
Казахстан
Синтез,
строение и биологическая активность производных декагидрохинолина
Производные
декагидрохинолина, как известно, проявляют различную биологическую активность
[1]. Авторами [2] был синтезирован ряд N-замещенных бензойных эфиров транс-декагидрохинолин-4-ола и
выявлена закономерность изменения анестезирующей активности в зависимости от
длины углеводородного радикала при атоме азота гетероцикла.
В
продолжение исследований нами были синтезированы некоторые производные
транс-декагидрохинолина и проведен биологический скрининг полученных соединений
для выяснения некоторых закономерностей зависимости строение – биологическая
активность.
Алкилированием
2е-метил-транс-декагидрохинолин-4-она этиловым эфиром бромуксусной кислоты в
сухом ацетоне в присутствии прокаленного поташа был синтезирован
N-карбэтоксиметил-2е-метил-транс-декагидрохинолин-4-он (1).
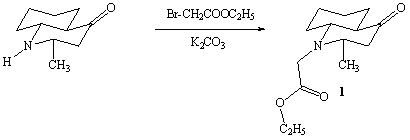
Соединение
(1) – бесцветные иглы с т.пл. 72-73°С. Состав и строение синтезированного
соединения были доказаны на основании данных элементного анализа, ИК- и
ПМР-спектроскопии, масс- спектрометрии.
Алкилированием
2е-метил-4е-окси-транс-декагидрохинолина этиловым эфиром бромуксусной кислоты в
сухом ацетоне в присутствии прокаленного поташа был синтезирован
N-карбэтоксиметил-2е-метил-4е-окси-транс-декагидрохинолин (2).
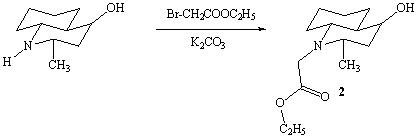
Соединение
(2) – бесцветные иглы с т.пл. 91-93°С. Состав и строение синтезированного
соединения были доказаны на основании данных элементного анализа, ИК- и
ПМР-спектроскопии, масс- спектрометрии.
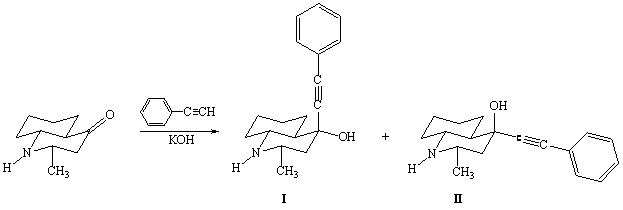
Конденсацией
2е-метил-транс-декагидрохинолин-4-она с фенилацетиленом была получена смесь
стерео-изомеров 2е-метил-4-фенилэтинил-4-окси-транс-декагидрохинолина. Затем,
используя дробную кристаллизацию, полученные стерео-изомеры были разделены.
Изомер (I) –
2е-метил-4а-фенилэтинил-4е-окси-транс-декагидрохинолин – представляет собой
белое кристаллическое вещество с т.пл. 127°С; изомер (II) –
2е-метил-4е-фенилэтинил-4а-окси-транс-декагидрохинолин – белое кристаллическое
вещество с т.пл. 147°С.
Выделенный
в чистом виде изомер (I)
(2е-метил-4а-фенилэтинил-4е-окси-транс-декагидрохинолин) алкилированием
этиловым эфиром бромуксусной кислоты был превращен в соединение (3) –
N-карбэтоксиметил-2e-метил-4a-фенилэтинил-4e-окси-транс-декагидрохинолин.
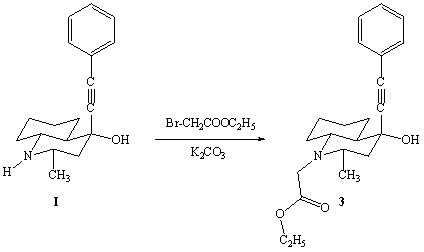
Вещество
(3) – бесцветные иглы с т.пл. 85-87°С.
Гидрохлориды
соединений (1), (2) и (3) были подвергнуты лабораторным испытаниям в ДГП
«Научно-исследовательский ветеринарный институт» ТОО НПО «Медбиофарм» на
антибактериальную активность против E. Coli, Salmonella
typhymurium, Salmonella choleraesuis. В качестве контроля использовался стрептомицин.
Результаты испытаний показали, что препараты не проявляют антибактериальной
активности, однако обладают низкой токсичностью, которая изучалась при
внутрибрюшинном введении белым мышам обоего пола и массой 17-22 г. Результаты
оценивались по показателю ЛД50
и изменению клинического состояния животных в течение 4 суток. В качестве
контроля использовался ципрофлоксацин (табл.1).
Таблица 1. Острая токсичность синтезированных соединений
|
№ |
Соединение |
ЛД50 при внутрибрюшинном введении мышам,
мг/кг |
ЛД50 при внутрибрюшинном введении крысам,
мг/кг |
|
1. |
Гидрохлорид
соединения (1) |
425,7±21,13 |
224,1±11,5 |
|
2. |
Гидрохлорид
соединения (2) |
555,7±21,13 |
314,1±11,5 |
|
3. |
Гидрохлорид
соединения (3) |
315,7±21,13 |
124,1±11,5 |
|
4. |
Ципрофлоксацин
(эталон) |
176,2±9,21 |
98,3±8,6 |
Спазмолитическая
активность синтезированных соединений изучалась на кишечнике белой крысы. В
качестве контроля использовался клемастин в разведении 1:100 (табл.2).
Таблица 2. Спазмолитическая активность синтезированных соединений
|
№ |
Соединение |
Изменение длины кишечника после введения препарата |
Активность при гистамин-ацетилхолиновом спазме (1 мг
ацетилхолина/1 мл среды) |
Активность при ацетилхолин-гистаминовом спазме (1 мг
гистамина/1 мл среды) |
|
1. |
Гидрохлорид
соединения (1) |
Ув. 2 мм |
Ум. 3 мм |
Ум. 5 мм |
|
2. |
Гидрохлорид
соединения (2) |
Ув. 2 мм |
Ум. 2 мм |
Ум. 4 мм |
|
3. |
Гидрохлорид
соединения (3) |
Ув. 1 мм |
Ум. 4 мм |
Ум. 4 мм |
|
4. |
Клемастин
(эталон) |
Ув. 3 мм |
Ум.4 мм |
Ум.5 мм |
Как
видно из таблиц 1 и 2 введение фенилэтинильной группировки в молекулу приводит
к повышению токсичности и снижению спазмолитической активности, тогда как
замена гидроксильной группы карбонильной приводит к повышению и токсичности и спазмолитической
активности. Синтезированные соединения рекомендованы к дальнейшему изучению в
качестве спазмолитиков.
Литература
1.
Соколов Д.В., Литвиненко Г.С., Хлуднева К.И. ЖОХ,
1960, 30, в.3, с.831.
2.
Хлуднева К.И., Литвиненко Г.С., Соколов Д.В. Химия
природных соединений и биологически активных веществ в Казахстане, 1967, 19, с.3.