УДК 669.884(574)
ОЦЕНКА КИНЕТИКИ ВЗАИМОДЕЙСТВИЯ МЕХАНОАКТИВИРОВАННОГО
СПОДУМЕНА
С СЕРНОЙ КИСЛОТОЙ
Самойлов В.И.
АО ”Ульбинский
металлургический завод”
(г. Усть-Каменогорск)
В гидрометаллургии лития перед сернокислотным вскрытием природного a-сподумена его подвергают дорогостоящему обжигу (декрипитации) при температуре ~11000C для придания минералу химической активности при взаимодействии с серной кислотой [1, 2, 3]. В процессе декрипитации a-сподумена происходит образование b-модификации сподумена. a- и b-модификации сподумена имеют одинаковый химический состав, а процесс a-b-перехода (декрипитации) затрагивает лишь кристаллическую структуру минерала: если a-форма имеет удельный вес 3,147 г/см3, то b-форма – 2,367 г/см3, что соответствует увеличению объема минерала почти на четверть. То есть декрипитацию a-сподумена можно представить как перегруппировку ионов, при котором расстояние между ними увеличивается, что делает кристаллическую решетку b-сподумена более подверженной действию молекул серной кислоты. В гидрометаллургических производствах после декрипитирующего обжига концентрат b-сподумена охлаждают, затем измельчают до крупности -70 мкм, после чего подвергают сульфатизации 93%-й серной кислотой при температуре ~2500С.
В данной работе на первом этапе оценивалась термодинамическая вероятность взаимодействия a-сподумена с серной кислотой в соответствии с предложенным уравнением реакции:
a-Li2O×Al2O3×4SiO2 + 4H2SO4
= Li2SO4 + Al2(SO4)3 +
4SiO2 + 4H2O
(1).
Изменение энергии Гиббса реакции (1) DG0298(р-ции) связано с изменением энтальпии DH0298(р-ции) и энтропии DS0298(р-ции) данной реакции (при стандартных условиях – температуре Т, 0К) уравнением Гиббса-Гельмгольца:
DG0298(р-ции) = DH0298(р-ции) – DS0298(р-ции)٠T.
Для определения DH0298(р-ции) = SDH0298(прод.) – SDH0298(исх.) требуется найти
SDH0298(прод.)=DH0298(Li2SO4)
+ DH0298(Al2(SO4)3)
+ 4٠DH0298(SiO2) +
4٠DH0298(SiO2)
и
SDH0298(исх.) = DH0298(a-Li2O×Al2O3×4SiO2) + 4DH0298(H2SO4).
При
расчете DS0298(р-ции) = SS0298(прод.) – SS0298(исх.)
необходимо определить SS0298(прод.) = S0298(Li2SO4) + S0298(Al2(SO4)3)
+ 4S0298(SiO2) + 4S0298(H2O)
и
SS0298(исх.) = S0298(a-Li2O×Al2O3×4SiO2) + 4S0298(H2SO4).
По
стандартным значениям энтальпии образования DH0298 и энтропии S0298
исходных веществ и
продуктов реакции (1)
(табл. 1) рассчитаны изменения
Таблица 1 – Стандартные энтальпии образования DH0298 и энтропии S0298 при 2980К (250С)
|
Исходные вещества и
продукты реакций (1) и (2) |
DH0298, кДж / моль |
S0298, Дж / моль . 0К |
Литературный источник |
|
a-Li2O×Al2O3×4SiO2 (т) |
–6084,4 |
258,32 |
[4] |
|
H2SO4 (ж) |
–814,422 |
157,458 |
[5] |
|
Li2SO4 (т) |
–1439,76* |
116,76** |
[1]*, [6]** |
|
Al2(SO4)3
(т) |
–3448,116 |
240,24 |
[5] |
|
SiO2 (т) |
–862,68 |
42,0 |
[5] |
|
H2O (ж) |
–286,931 |
70,207 |
[5] |
энергии Гиббса (DG0298(р-ции)), энергии системы (DH0298(р-ции)) и беспорядка в ней (DS0298(р-ции)), составившие DH0298(р-ции) = –144,2 кДж/моль, DS0298(р-ции) = –50,672 Дж/моль٠0К, DG0298(р-ции) = –129,1 кДж/моль.
Из результатов
данного расчета следует, что реакция (1) не только термодинамически
вероятна, но и необратима, т.к. DG0298(р-ции) < –40 кДж/моль
[7].
Для определения термодинамической вероятности любого процесса можно также рассчитать DG0298(р-ции), пользуясь справочными величинами DG0298.
Суммарный эффект влияния движущихся сил на реакцию (1), протекающую при
постоянной температуре и давлении, отражается изменением ее энергии Гиббса DG0298(р-ции):
DG0298(р-ции) = SDG0298(прод.) – SDG0298(исх.),
где SDG0298(прод.)=DG0298(Li2SO4)+DG0298(Al2(SO4)3)+4DG0298(SiO2)+4DG0298(H2O),
SDG 0298(исх.) = DG 0298(a-Li2O×Al2O3×4SiO2) + 4DG 0298(H2SO4).
По справочным материалам [4-6] в данной работе определены:
SDG0298(прод.) = (–1328,25) + (–3103,758) + 4×(–808,08) + 4×(–238,098) =
= –8616,72 кДж/моль,
SDG0298(исх.) = –5738,56 + 4×(–689,22) = –8495,44 кДж/моль,
DG0298(р-ции) = –8616,72 – (–8495,44) = –121,28 кДж/моль.
Полученное таким образом большое отрицательное значение DG0298(р-ции) также свидетельствует о необратимости протекания реакции (1) в прямом направлении при стандартной температуре.
Величина
DG0298(р-ции),
рассчитанная двумя методами, находится в пределах от –129 кДж/моль до –121
кДж/моль и составляет –125±4 кДж/моль.
Несмотря
на установленную термодинамическую вероятность взаимодействия a-сподумена
с серной кислотой на практике это взаимодействие протекает очень медленно и
лимитируется, по-видимому, достаточно плотным экранированием ионов лития и
алюминия кремнийкислородной основой минерала (рис.
1), а также скоростью диффузии молекул серной кислоты к поверхности минерала
через слой образующегося гидратированного
кремнезема. Так, по данным [2] без предварительной декрипитации
a-сподумена
серная кислота позволяет извлечь из него за 3 ч лишь ~4% масс. лития при
температуре 3000С.
В данной работе предложен альтернативный способ подготовки a-сподумена к сернокислотному вскрытию, предусматривающий исключение из технологического процесса энергоемкой, дорогостоящей операции декрипитации и стадии охлаждения b-сподумена. Установлено, что это возможно в случае, если применяемая в гидрометаллургии лития операция измельчения сподумена обеспечивает получение требуемой удельной поверхности α-сподумена (его крупности) и необходимой степени разрушения кристаллической решетки дан-

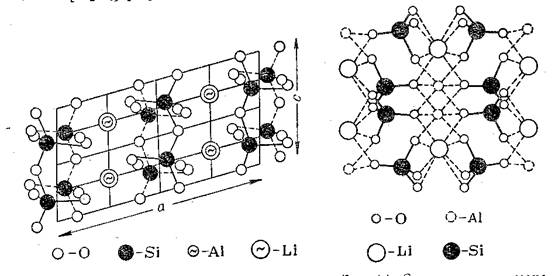
 Сподумен кристаллизуется в
моноклинной сингонии; параметры
кристаллической решетки (А): а=9,50; в=8,30; с=5,24.Все цепочки Si–O одинаковы по структуре.
Среднее Si–O
расстояние равно 1,6 А. Литий и алюминий окружены каждый шестью ионам кислорода
со средним расстоянием 2,26А (Li–O) и 2,07A (Al–O)
Сподумен кристаллизуется в
моноклинной сингонии; параметры
кристаллической решетки (А): а=9,50; в=8,30; с=5,24.Все цепочки Si–O одинаковы по структуре.
Среднее Si–O
расстояние равно 1,6 А. Литий и алюминий окружены каждый шестью ионам кислорода
со средним расстоянием 2,26А (Li–O) и 2,07A (Al–O)
Рисунок
1 – Структура кристаллической решетки сподумена [1]
а – проекция на грань (010) цепочки
кремния кислорода, параллельной оси с;
б – проекция на плоскость
(0001)
ного минерала. То есть исключение операций декрипитации и охлаждения сподумена возможно при
достаточной степени механоактивации α-сподумена.
Экспериментальные исследования выполнены с
использованием a-сподумена
крупностью –150 мкм с содержанием Li2O 6,9%
масс., для механоактивации которого применяли лабораторный виброистиратель и планетарную мельницу (рис. 2) АИР-0,015М
«Гидроцветмета», Новосибирск (диаметр мелющих шаров
На рис. 3 представлены результаты рентгеноструктурного
анализа сподумена, механоактивированного с
использованием виброистирателя и планетарной
мельницы, а также данные о гранулометрическом составе механоактивированного
продукта. Данные термографического анализа механоактивированного
сподумена приведены на рис. 4.
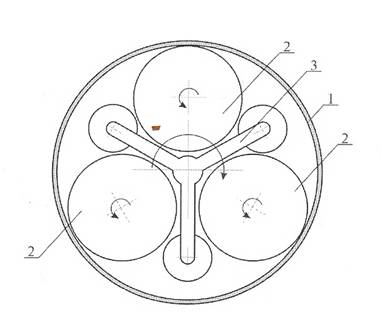
Рисунок 2 – Схема работы планетарной мельницы
1 – корпус мельницы; 2 –
барабан с шарами; 3 – водило
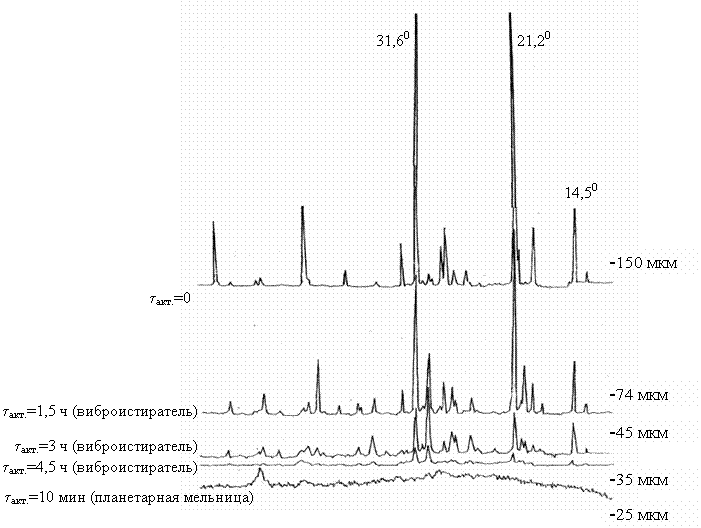
Рис. 3 – Состояние кристаллической решетки и гранулометрического состава механоактивированного a-сподумена (tакт. – продолжительность активации)
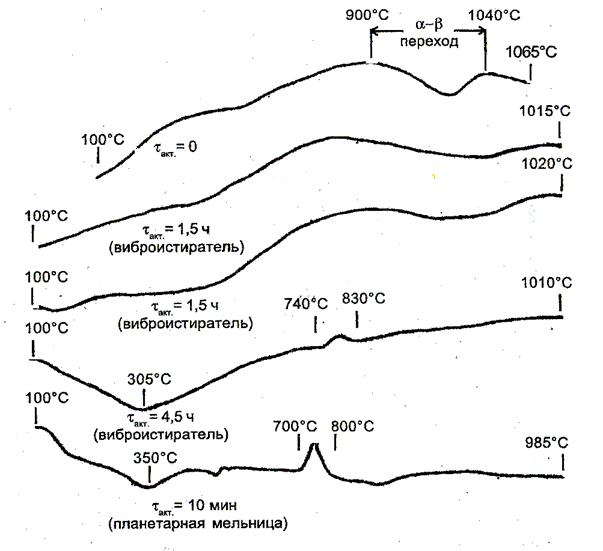
Рис. 4 – Дифференциальные
температурные кривые нагревания сподумена,
механоактивированного в течение tакт.
Анализ
данных рис.3 показывает, что процесс активации α-сподумена с
использованием виброистирателя сопровождается
прогрессирующим разрушением кристаллической решетки минерала (при увеличении
продолжительности измельчения до 4,5 ч) с одновременным снижением крупности
α-сподумена с -150 мкм до -35
мкм. Кроме того, из данных рис. 3 следует, что измельчение α-сподумена в
энергонагруженной плантарной
мельнице позволяет достичь большего разрушения кристаллической решетки
минерала и получить более развитую его поверхность всего за 10 мин.
Результаты термографического анализа измельченного на виброистирателе
α-сподумена (рис. 4) показывают, что выброс аккумулированной при его
измельчении в течение 4,5 ч энергии происходит при ~8300С. При нагревании измельченного в течение 10 мин в планетарной
мельнице α-сподумена аккумулированная в ходе его измельчения энергия
выделяется уже при температуре ~8000С
(рис. 4), а величина наблюдаемого экзотермического эффекта возрастает
приблизительно вдвое, что также свидетельствует о более высокой эффективности
использования планетарной мельницы для механоактивации α-сподумена
в сравнении с виброистирателем.
В
данной работе исследована кинетика процесса сульфатизации механоактивированного
10 мин в планетарной мельнице α-сподумена с 93%-й серной кислотой и определена
степень извлечения лития из активированного минерала в водорастворимый Li2SО4 при различной
температуре сульфатизации.
Навески минерала массой
При определении
влияния температуры сульфатизации на степень извлечения лития из механоактивированного сподумена в водорастворимый
Li2SО4 получены данные, приведенные в табл. 2.
Таблица 2 – Зависимость извлечения лития в раствор от температуры сульфатизации (продолжительность сульфатизации – 5 ч)
|
Темпера-тура, 0С |
Остаток выщелачивания |
Извлечение Li в раствор, % масс. |
Скорость сульфатизации Li2O, мг/мин |
|
|
Масса, г |
Содержание Li2O, % масс. |
|||
|
150 |
8,1 |
3,83 |
55,0 |
1,265 |
|
200 |
7,9 |
2,75 |
68,5 |
1,575 |
|
250 |
7,6 |
1,92 |
78,9 |
1,815 |
|
300 |
7,5 |
0,83 |
91,0* |
2,093 |
Примечание. * - извлечение алюминия составляет 50% масс.; применение
в процессе сульфатизации периодического растирания реакционной массы пестиком
(с целью удаления с поверхности механоактивированного
a-сподумена
продуктов реакции и облегчения тем самым доступа молекул серной кислоты к
реакционной поверхности) позволяет извлечь из минерала 93÷95% масс.
лития и 59÷61% алюминия.
Из данных табл. 2 следует, что при увеличении температуры процесса со
1500С до 3000С извлечение лития в раствор и скорость
сульфатизации Li2O возрастают в ~1,7 раза (соответственно с 55 до 91%
масс. и с 1,265 до 2,093 мг/мин).
Оценка кинетики взаимодействия механоактивированного α-сподумена с серной кислотой выполнена с использованием уравнения Аррениуса:
lgV = –Eкаж./4,574Т + С,
![]() где
V – скорость
сульфатизации Li2O механоактивированного
α-сподумена, моль/мин; Eкаж – “кажущаяся” энергия активации
реакции механоактивированного α-сподумена с
серной кислотой, кал/моль; Т – температура сульфатизации, 0К; С –
постоянная. Для расчета кинетики процесса составлена табл. 3 с использованием
данных табл. 2.
где
V – скорость
сульфатизации Li2O механоактивированного
α-сподумена, моль/мин; Eкаж – “кажущаяся” энергия активации
реакции механоактивированного α-сподумена с
серной кислотой, кал/моль; Т – температура сульфатизации, 0К; С –
постоянная. Для расчета кинетики процесса составлена табл. 3 с использованием
данных табл. 2.
Таблица 3 –
Скорость сульфатизации Li2O механоактивированного
α-сподумена
|
Температура |
1/Т, 0К-1 |
Скорость сульфатизации Li2O |
Значение lg V |
||
|
0С |
0К |
мг/мин |
моль/мин |
||
|
150 |
423 |
0,00236 |
1,265 |
0,000042 |
-4,377 |
|
200 |
473 |
0,00211 |
1,575 |
0,000052 |
-4,284 |
|
250 |
523 |
0,00191 |
1,815 |
0,000060 |
-4,222 |
|
300 |
573 |
0,00175 |
2,093 |
0,000070 |
-4,155 |
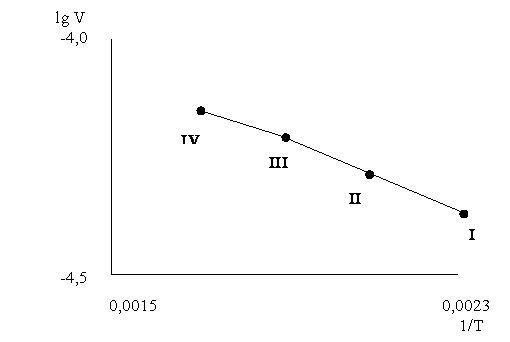
Расчет величин Eкаж и С, входящих в зависимость lgV = f(Т) (рис. 5), для участка I-II выполнен по данным табл. 3. При
температуре реакции 150
и 2000С подстановка
соответствующих численных значений из табл. 3 в уравнение Аррениуса дает 2
уравнения с двумя неизвестными: –4,377 =–0,00236 Eкаж./ /4,574+С и –4,284=–0,00211Eкаж./4,574+С.
После совместного решения данных уравнений получаем Eкаж.=1550 кал/моль=6,51
кДж/моль, С=–3,57.
Аналогичным
образом рассчитаны и приведены в табл. 4 величины Eкаж. и С,
входящие в графическую зависимость lgV = f(Т) (рис. 5), для участков II-III и III-IV.
Из данных табл. 4 следует, что на участках I-II, II-III и III-IV, судя по соответствующим величинам Eкаж.
реакции, она вероятнее всего протекает в диффузионной области и
лимитируется скоростью диффузии молекул серной кис-
![]()
Рисунок 5 – Зависимость
логарифма скорости реакции механоактивированного
α-сподумена с серной кислотой от обратной температуры реакции
Таблица 4 – Расчет кинетики взаимодействия механоактивированного α-сподумена с 93%-й серной кислотой при температуре 150÷3000С
|
Участок зависимости lgV = f(Т) по рис. 5 |
Значение Eкаж. реакции |
Постоянная С |
|
|
кал/моль |
кДж/моль |
||
|
I-II |
1550 |
6,51 |
–3,57 |
|
II-III |
1550 |
6,51 |
–3,57 |
|
III-IV |
1675 |
7,03 |
–3,52 |
Примечание. Значения “кажущейся” энергии активации реакций
для кинетических, переходных и диффузионных процессов составляют
соответственно 40÷300 кДж/моль, 20÷40 кДж/моль, 8÷20
кДж/моль [7].
лоты к реакционной поверхности
через слой образующегося гидратированного
кремнезема. На участках
I-II, II-III и III-IV
зависимость lgV = f(Т) по результатам расчета кинетики
процесса (табл. 4) выражается следующими уравнениями:
– на участке
I-II уравнением lgV = –338,9/T – 3,57;
– на участке
I-II уравнением lgV = –338,9/T – 3,57;
– на участке III-IV уравнением lgV = –366,3/T – 3,52.
Вывод.
Исследована кинетика взаимодействия механоактивированного a-сподумена
с серной кислотой. Установлено, что механоактивация a-сподумена
с получением рентгеноаморфного продукта крупностью
–25 мкм обеспечивает в дальнейшем промышленно-приемлемое вскрытие минерала
серной кислотой.
Список литературы
1 Плющев В.Е.,Степин Б.Д. Химия и технология соединений лития, рубидия и цезия. – М.: Химия, 1970. – 408 с.
2
Извлечение и очистка редких металлов. Пер. с англ. О.П. Колчина. – М.: Атомиздат, 1960. – 512 с.
3 Самойлов В.И. Экспериментальная разработка перспективных химических методов извлечения бериллия и лития из минерального сырья. – Усть-Каменогорск: Медиа-Альянс, 2006. – 551 с.
4 Булах А.Г., Булах К.Г.
Физико-химические свойства минералов и компонентов гидроминерального сырья. –
Л.: Недра, 1978. – 167 с.
5 Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. – Киев: Наукова думка,1974. – 660 с.
6 Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. – М.: Химия, 1968. – 472 с.