Прогностическая роль HLA-DR в CD3 в оценке развития септических состояний.
Куценко Е.В., Трещинский А.И.
КНМУ
им. О.О. Богомольця, НМАПО им. П.Л.Шупика
Широкие возможности современной диагностики не всегда решают вопрос
правильной постановки диагноза. Мы наблюдаем примеры, когда заболевания разные
по этиологии демонстрируют одинаковые клинические проявления, что связано с
развитием синдрома системного воспалительного ответа (ССВО)[1], который до
определенного момента развития патологического процесса имеет сходные механизмы
своего развития [4,5]. Сходные механизмы ССВО для разных заболеваний диктуются
неспецифическим звеном иммунной защиты[2]. Далее включается специфическое
звено, которое диктует условия дальнейшего развития патологического процесса,
его направление и определяет его исход, который в большинстве случаев зависит
от сохранности и компенсаторных возможностей иммунной системы[2,4,5].
Цель исследования: Определить изменения в
лимфоцитарных субпопуляциях, характерных для развития септических состояний .
Тип исследования: двойное, слепое,
рандомизированное
Материалы и методы:
95 больных с разной патологией и
разной степенью выраженности развития ССВО были обследованы при поступлении и
на 14-й день нахождения в стационаре. Все больные имели тяжелую патологию
бактериального и небактериального происхождения: политравма (ПТ) (n=20) без повреждения внутренних
органов брюшной полости; разлитой перитонит (ПН) (n=20); системные заболевания (СЗ) в
активной фазе (n=25); инфекционный эндокардит (ИЭ) в активной фазе (n=30). Наличие бактериальной культуры
в случаях перитонита и инфекционного эндокардита подтверждено
бактериологическими лабораторными исследованиями.. Крайне тяжелые больные с
прогрессивным ухудшением состояния обследовались дополнительно в динамике.
Общее состояние всех больных в первые и 14-е сутки оценены по тяжести состояния
с помощью шкалы SAPS,
С целью выявления характерных признаков заболеваний бактериального
происхождения проведено исследование крови пациентов по 38 показателям, включающим
характеристики специфической и неспецифической иммунной защиты. Среди этих
исследований 27 клеточных субпопуляций и их активных форм исследовано методом
трехцветной проточной цитофлюорометрии на аппарате FACScan (Becton-Dickenson Immunocytometry Systems, San Jose, CA, USA) c использованием соответственных
моноклональных антител (Becton-Dickenson). Математическая обработка
статистических данных полученных результатов проведенных исследований
проводилась с помощью программ STATISTICA и MS EXСEL. Поскольку полученные вариационные ряды были приближены к
нормальному закону перераспределения, были рассчитаны средние значения
количественных показателей и их стандартные ошибки. Для определения вероятности
расхождений между соответствующими показателями двух групп использовался
критерий Стьюдента.
Результаты.
В соответствии с полученными результатами наиболее результативными
оказались расхождения среди Т-лимфоцитов
с экспрессированными на них
активационными поверхностно-клеточными молекулами HLA+DR- . повышение экспрессии этих молекул
на Т-клетках на момент поступления больных в стационар наблюдалась только в
случаях бактериального происхождения. Подтверждалась их причастность к
идентификации бактериального компонента уменьшением экспрессии этих молекул на 14
сутки пребывания у больных с
положительной клинической динамикой.
На диаграмме, представленной ниже демонстрируется динамика экспрессии
молекул HLA+DR- в первые и четырнадцатые сутки у больных с положительной динамикой.
Горизонтальными линиями обозначен диапазон нормы
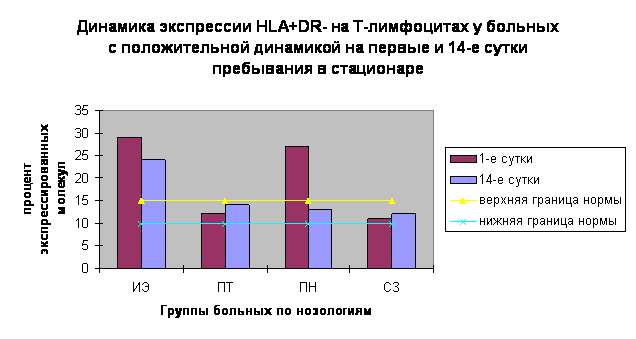
Недостаточное снижение процента активированных молекул у больных ИЭ по сравнению с больными с бактериальным перитонитом на 14-й
объясняется длительностью лечения этой категории больных. Как правило устранение
поврежденного клапана и имплантация искусственного требует длительной
реабилитации и длительной антибиотикотерапии в сравнении с больными, леченными по
поводу разлитого перитонита[3].
Выводы:
1. Специфическое звено иммунологического
ответа в случаях заболеваний бактериального и небактериального присхождения
имеетсвои отличительные признаки.
2. Скорее всего эти признаки мы можем
определить по экспрессии поверхностно-активных молекул, которые характеризуют
направление иммунологического ответа.
3. В наших исследованиях таким маркером
оказались молекулы HLA+DR- на Т-лимфоцитах.
Понятно, что по одному, полученному нами
маркеру, нельзя делать далеко идущие выводы. Исследования в этом направлении
нужно продолжать, чтобы получить комплекс характеристик, которые позволят
определять не только направление иммунологических реакций, но и правильность
нашей терапевтической тактики.
Список литературы:
1. Bone R.C., Balk R.A., Cerra F.B. Definitions for sepsis and Organ
failure and guidelinesfor the use of innovative therapies in sepsis.//Crit Care
Med.1992, 20(6) pp864-74.
2.Г.Лолор-младший, Т.Фишер, Д.Адельман
Клиническая иммунология и аллергология//Практика. Москва. 2000.
3. Куценко Е.В., Руденко А.В. Трещинский А.И. Количественные
изменения в популяциях лимфоцитов как показатель эндогенной интоксикации.// Біль, знеболювання,
інтенсивна терапія. 2000, №1(9) с.247-253.
4.Плейфэр Дж. Наглядная иммунология.
Медицина. Москва. 1998г.
5.Хаитов Р.М., Пинегин Б.В. Современные
представления о защите организма от инфекций.
Иммунология, 2000, №1, с.61-64.
Куценко Олена Володимирівна
НМУ ім. О.О. Богомольця, асистент кафедри анестезіології та інтенсивної
терапії, к.мед.н.
К.тел. 8.067 507 99 55
Р.тел. 249-78-23
Тріщинський Анатолій
Іванович професор кафедри анестезіології та інтенсивної терапії НМАПО, доктор
мед.наук, керівник наукової работи.
Секція – медицина:
14-анестезіологія та інтенсивна терапія.
.
