УДК 669.725.3
ПРЕДВАРИТЕЛЬНАЯ
ОЦЕНКА КИНЕТИКИ И ТЕРМОДИНАМИКИ ВЗАИМОДЕЙСТВИЯ БЕРИЛЛА С СЕРНОЙ КИСЛОТОЙ
1 Самойлов В.И., 2 Куленова Н.А ., 2Шерегеда З.В., 2Жаглов
В.С.
1 – АО ”Ульбинский металлургический
завод”, 2 “Восточно-Казахстанский
государственный технический
университет им. Д. Серикбаева”
(г. Усть-Каменогорск)
Перспективность непосредственного вскрытия силикатного сырья серной кислотой в гидрометаллургии бериллия заключается в отсутствии затрат на активацию сырья [1], составляющих 20÷25% от суммарных затрат в гидрометаллургии. Энергия кристаллической решетки берилла, фенакита, бертрандита на 1 атом кислорода соответственно составляет, ккал/моль: 1433,2; 1331,62; 1162,76 [2]. Эти данные показывают, что химическая прочность указанных минералов увеличивается при переходе от бертрандита к фенакиту и далее к бериллу. Известно [3], что берилл весьма устойчив по отношению к химическим реагентам. При обычной температуре в едва заметной степени с ним взаимодействует только плавиковая кислота. Было затрачено много усилий на изучение реакций, происходящих при высокой температуре между бериллом и хлором, фтористым водородом и газообразным бифторидом аммония [3]. Однако, как отмечают авторы [3], до настоящего времени не было предложено промышленных процессов, основанных на этих высокотемпературных реакциях в газовой фазе.
Дарвин Дж. и Баддери Дж. [4] отмечают, что берилл взаимодействует с серной кислотой очень медленно, но при определенных условиях можно добиться заметного ускорения реакции. Так, по данным [4] взаимодействие берилла с концентрированной серной кислотой в автоклаве позволяет перевести за несколько часов в водорастворимую форму до 50÷60% бериллия. Реакция ускоряется в присутствии фторидов, по-видимому, благодаря фтористому водороду, однако скорость реакции и в этом случае остается малой.
Экономическая
целесообразность прямой сульфатизации того или иного минерала определяется
его химической прочностью, зависящей от многих факторов. Непосредственное вскрытие
бертрандита серной кислотой применяется на заводе фирмы
“Браш Веллман” (США) и
характеризуется высокой экономической эффективностью. В данной работе
выполнена предварительная оценка кинетики
и термодинамики процесса взаимодействия берилла с серной кислотой.
1 Кинетика взаимодействия берилла с серной кислотой
Целью данной работы являлось определение степени извлечения Ве из берилла в водорастворимый ВеSО4 при различных температурах и продолжительностях выщелачивания минерала.
Объектом исследований являлся берилл крупностью –45 мкм, содержавший 11% масс. ВеО. Установлено [1], что максимальная скорость растворения берилла в серной кислотой достигается при ее концентрации 69%. Навески минерала массой 500 мг (55 мг по ВеО) обрабатывали 10 мл 69%-й серной кислоты и выдерживали при перемешивании полученной пульпы при заданных температурах и продолжительностях выщелачивания. После окончания опыта пульпу выщелачивания фильтровали. Отфильтрованный осадок обрабатывали в стакане горячей дистиллированной водой, отделяли от промывного раствора, сушили, анализировали на содержание ВеО фотонейтронным методом.
При
определении влияния температуры процесса на степень извлечения бериллия из
берилла в водорастворимый сульфат бериллия получены
данные, приведенные в табл. 1.
Таблица 1 – Зависимость извлечения Ве в раствор от температуры выщелачивания (продолжительность выщелачивания – 40 ч)
|
Темпера-тура, 0С |
Остаток выщелачивания |
Извлечение Ве в раствор, % масс. |
Cкорость растворения ВеО, мг/мин |
|
|
Вес, мг |
Содержание ВеО, % масс. |
|||
|
25 |
479,5 |
11,0 |
4,10 |
0,0009 |
|
80 |
379,4 |
10,8 |
25,50 |
0,0058 |
|
130 |
190,5 |
11,0 |
61,90 |
0,0142 |
|
165 |
50,5 |
10,9 |
89,99 |
0,0201 |
Из данных табл. 1 следует, что при увеличении температуры процесса с 250С
до 1650С извлечение бериллия в раствор и скорость растворения ВеО возрастают в ~22 раза (соответственно с 4,1 до ~90%
масс. и с 0,0009 до 0,0201 мг/мин).
В табл. 2 представлены результаты опытов, проводившихся аналогично предыдущей серии, но при различной продолжительности выщелачивания и температуре 1650С.
Как следует из данных табл. 2, при увеличении продолжительности процесса
с 5 ч до 40 ч извлечение Ве в раствор возрастает в
1,6 раза (с 56 до ~90 % масс.), а скорость растворения ВеО
падает почти в 5,1 раза (с 0,1027 до 0,0201 мг/мин).
Таблица 2 – Зависимость извлечения Ве в раствор от продолжительности выщелачивания
|
Продолжитель-ность, ч |
Остаток выщелачивания |
Извлечение Ве в раствор, % масс. |
Cкорость растворения ВеО, мг/мин |
|
|
Вес, мг |
Содержание ВеО, % масс. |
|||
|
5 |
223,0 |
10,85 |
56,01 |
0,1027 |
|
13 |
177,0 |
11,19 |
63,99 |
0,0451 |
|
25 |
122,0 |
11,27 |
75,00 |
0,0275 |
|
30 |
98,0 |
10,66 |
81,01 |
0,0247 |
|
35 |
72,0 |
10,69 |
86,01 |
0,0225 |
|
40 |
50,5 |
10,90 |
89,99 |
0,0201 |
В данной работе выполнена оценка кинетики взаимодействия берилла с серной кислотой с использованием уравнения Аррениуса:
lgV = –Eкаж./4,574Т + С,
где V – скорость растворения ВеО из берилла, моль/мин; Eкаж.– “кажущаяся” энергия активации реакции берилла с серной кислотой, кал/моль; Т – температура растворения, 0К; С – постоянная. Для расчета кинетики процесса составлена табл. 3 с использованием данных табл. 1.
Таблица 3 – Скорость взаимодействия берилла с H2SO4
|
Температура |
1/Т, 0К-1 |
Скорость растворения ВеО из берилла |
Значение lg V |
||
|
0С |
0К |
мг/мин |
моль/мин |
||
|
25 |
298 |
0,003356 |
0,0009 |
0,000000036 |
-7,444 |
|
80 |
353 |
0,002833 |
0,0058 |
0,000000232 |
-6,635 |
|
130 |
403 |
0,002481 |
0,0142 |
0,000000568 |
-6,246 |
|
165 |
438 |
0,002283 |
0,0201 |
0,000000804 |
-6,095 |
Расчет величин Eкаж и С, входящих в зависимость lgV = f(Т) (рис. 1), для участка I-II выполнен по данным табл. 3. При
температуре реакции 25 и 800С подстановка соответствующих численных
значений из табл. 3 в уравнение Аррениуса дает 2 уравнения с двумя неизвестными:
–7,444 =–0,003356 Eкаж./ /4,574+С и
–6,635=–0,002833Eкаж./4,574+С. После совместного
решения данных уравнений получаем Eкаж.=7354,5 кал/моль=30,9 кДж/моль, С=–2,05.
Аналогичным
образом рассчитаны и приведены в табл. 4 величины Eкаж. и С,
входящие в графическую зависимость lgV = f(Т) (рис. 1), для участков II-III и III-IV.
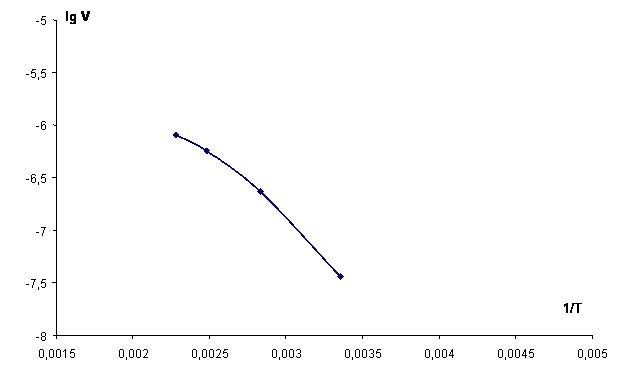
Рисунок 1 – Зависимость логарифма скорости реакции берилла с серной кислотой от обратной температуры реакции
Таблица 4 – Расчет кинетики взаимодействия берилла с 69%-й серной кислотой при температуре 25÷1650С
|
Участок зависимости lgV = f(Т) по рис. 1 |
Значение Eкаж. реакции |
Постоянная С |
|
|
кал/моль |
кДж/моль |
||
|
I-II |
7354,5 |
30,9 |
–2,05 |
|
II-III |
5054,6 |
21,2 |
–3,50 |
|
III-IV |
3488,9 |
14,7 |
–4,35 |
Примечание. Значения “кажущейся” энергии активации реакций для кинетических, переходных и диффузионных процессов составляют соответственно 40÷300 кДж/моль, 20÷40 кДж/моль, 8÷20 кДж/моль [5].
Из данных
табл. 4 следует, что на участках I-II, II-III, судя по соответствующим величинам
Eкаж.
реакции, она протекает в переходной области, а на участке III-IV – в диффузионной области. На участках I-II, II-III, III-IV зависимость lgV = f(Т) по результатам расчета кинетики
процесса (табл. 4) выражается следующими уравнениями:
–
на участке I-II уравнением lgV = –1607,9/T – 2,05;
–
на участке II-III уравнением lgV = –1105,1/T – 3,50;
– на участке III-IV уравнением lgV = –762,8/T – 4,35.
Данные кристаллооптического и рентгеноструктурного анализа нерастворимых остатков от сернокислотного выщелачивания фенакита, приведенные в отчете [6], показывают, что взаимодействие фенакита с серной кислотой тормозится выделением гидратированного коллоидного кремнезема состава SiO2 ٠ nН2О на поверхности зерен фенакита. Появление пленки кремнезема на поверхности зерен фенакита, толщина которой составляет ~10 мкм, затрудняет доступ растворителя к частицам фенакита. Можно предположить, что при сернокислотном выщелачивании берилла процесс также лимитируется скоростью диффузии молекул кислоты через слой гидратированного кремнезема.
2 Термодинамика
взаимодействия берилла с серной кислотой
В данной работе предложено следующее уравнение взаимодействия берилла с
серной кислотой:
3BeO.Al2O3.6SiO2 + 6H2SO4 = 3BeSO4 + Al2(SO4)3 + 6SiO2 + 6H2O (1).
Изменение энергии Гиббса реакции (1) DG0298(р-ции) связано с изменением энтальпии DH0298(р-ции) и энтропии DS0298(р-ции) указанной реакции (при стандартных условиях – температуре Т, 0К) уравнением Гиббса-Гельмгольца:
DG0298(р-ции) = DH0298(р-ции) – DS0298(р-ции)٠T,
Для определения DH0298(р-ции) = SDH0298(прод.) – SDH0298(исх.) требуется найти SDH0298(прод.)=3٠DH0298(ВеSO4)+DH0298(Al2(SO4)3)+6٠DH0298(SiO2)+6٠DH0298(H2O)
и SDH0298(исх.)
= DH0298(3ВеO٠Al2O3٠
6SiO2)
+ 6٠DH0298(H2SO4).
При
расчете DS0298(р-ции) = SS0298(прод.) – SS0298(исх.)
необходимо определить SS0298(прод.) = 3٠S0298(ВеSO4)
+ S0298(Al2(SO4)3) + 6٠S0298(SiO2) +
6٠S0298(H2O)
и SS0298(исх.)
= S0298(3ВеO٠Al2O3٠6SiO2) + 6٠S0298(H2SO4).
По
стандартным значениям энтальпии образования DH0298 и энтропии S0298
исходных веществ и продуктов реакции
(1) (табл. 5) рассчитаны изменения
Таблица 5 – Стандартные энтальпии образования DH0298 и энтропии S0298 при 2980К (250С)
|
Исходные вещества и продукты реакции (1) |
DH0298, кДж / моль |
S0298, Дж / моль . 0К |
Литературный источник |
|
3ВеO٠Al2O3٠6SiO2
(т) |
– |
– |
Нет данных |
|
H2SO4 (ж) |
–814,42 |
157,458 |
[7] |
|
BeSO4 (т) |
–1201,2 |
90,3 |
[7] |
|
Al2(SO4)3 (т) |
3448,116 |
240,24 |
[7] |
|
SiO2 (т) |
–862,68 |
42,0 |
[7] |
|
H2O (ж) |
–286,93 |
70,207 |
[7] |
энергии Гиббса (DG0298(р-ции)), энергии системы (DH0298(р-ции)) и беспорядка в ней (DS0298(р-ции)), составившие:
DH0298(р-ции) = – DH0298(берилла)
– 9062,78 (кДж/моль),
DS0298(р-ции) = – S0298(берилла)
+ 0,239 (кДж/моль٠0К),
DG0298(р-ции) = 298S0298(берилла)
– DH0298(берилла)
– 9134 (кДж/моль)
(2).
Для
любого процесса DG0298(р-ции) можно рассчитать также по справочным
величинам DG0298.
Суммарный эффект влияния движущихся сил на реакцию (1), протекающую при
постоянной температуре и давлении, отражается изменением ее энергии Гиббса DG0298(р-ции):
DG0298(р-ции) = SDG0298(прод.) – SDG0298(исх.),
где SDG0298(прод.)=3٠DG0298(ВеSO4)+DG0298(Al2(SO4)3)+6٠DG0298(SiO2)+
+6٠DG0298(H2O),
SDG 0298(исх.) = DG 0298(3ВеO٠Al2O3٠6SiO2) + 6٠DG 0298(H2SO4).
По справочным материалам [7] в данной работе определены:
SDG0298(прод.)=3×(–1092,8)+(–3103,8)+6×(–808,1)+6×(–238,1)=–12659,4 (кДж/моль),
SDG0298(исх.)=DG0298(берилла) + 6×(–689,22)=DG0298(берилла) – 4135,3 (кДж/моль),
DG0298(р-ции) = – DG0298(берилла) – 8524,1 (кДж/моль) (3).
Если принять, учитывая материалы первого раздела данной работы, что реакция (1) термодинамически вероятна, то из выражения (3) получаем:
– DG0298(берилла) – 8524,1 < 0, а DG0298(берилла) > – 8524,1 кДж/моль.
Кроме того, из уравнений (2) и (3) следует, что
298S0298(берилла) – DH0298(берилла) – 9134 = – DG0298(берилла) – 8524,1.
После преобразования данного равенства получаем:
DG0298(берилла) = DH0298(берилла) –
298DS0298(берилла), (4)
где энтропия образования берилла DS0298(берилла)=S0298(берилла) – 2,05 (кДж/моль٠0К).
В этом выражении постоянная 2,05 представляет собой суммарную энтропию исходный веществ (бериллия, алюминия, кремния и кислорода), которые необходимы для образования берилла. Расчет суммарной энтропии исходных веществ по справочным данным [7] с учетом коэффициентов в формуле берилла показал, что суммарная энтропия составляет 2,05 кДж/моль٠0К. Тем самым, подтверждена правильность сделанных расчетов.
Величину DG0298(берилла) можно
также оценить рассчитав изменение энергии Гиббса реакции разложения берилла с
образованием фенакита (2ВеO٠SiO2),
хризоберилла (ВеO٠Al2O3) и оксида
кремния:
3ВеO٠Al2O3٠6SiO2 = 2ВеO٠SiO2 + ВеO٠Al2O3 + 5SiO2 (5).
Сумма стандартных значений DG0298
продуктов реакции (5), приведенных в справочной литературе [7, 8] составляет
–8243,8 кДж/моль, а значение DG0298(р-ции) для реакции (5):
DG0298(р-ции) = SDG0298(прод.) – SDG0298(исх.) =
–8243,8 – DG0298(берилла).
При
стандартных условиях реакция (5) термодинамически
неосуществима, т.е. DG0298(р-ции) > 0. Следовательно, DG0298(берилла) < –8243,8 кДж/моль.
Таким образом, ориентировочный расчет величины DG0298(берилла), выполненный с использованием
уравнений (1) и (5), показывает, что эта величина находится в пределах от
–8524 кДж/моль до –8244 кДж/моль и составляет –8384±140 кДж/моль. После
подстановки данного значения DG0298(берилла) в
выражение (4) и последующего преобразования этого выражения получено соотношение
между стандартными значениями энтальпии образования берилла и энтропией
берилла:
DH0298(берилла) = 298S0298(берилла) – 8995 ±140 (кДж/моль).
Вывод.
Исследована
кинетика и термодинамика взаимодействия берилла с серной кислотой и выполнена
предварительная оценка энергии
Гиббса образования берилла. Ее ориентировочное значение составляет DG0298(берилла)
> –8524,1 кДж/моль
= –8384 ±140
кДж/моль.
Список литературы
1
Самойлов В.И. Экспериментальная разработка перспективных химических методов
извлечения бериллия и лития из минерального сырья. – Усть-Каменогорск: Медиа-Альянс, 2006. – 551 с.
2
Коленкова М.А., Крейн О.Е.
Металлургия рассеянных и легких редких металлов. – М.: Металлургия, 1977. – 360
с.
3 УайтД., Берк Дж. Бериллий. – М.: ИЛ, 1960. – 616 с.
4
Дарвин
Дж., Баддери Дж. Бериллий. – М.: ИЛ, 1962. – 324
с.
5
Зеликман А.Н., Вольдман Г.М., Беляевская
Л.В. Теория гидрометаллургических процессов. – М.: Металлургия, 1983. – 423
с.