Т.Ю.
Трохимчук1, к.б.н.
М.П. Завелевич2, к.б.н.
А.А. Фильченков2,
д.м.н.
С.Л. Рыбалко1, д.м.н. А.И. Гриневич3, д.м.н. Н.В. Иванская1,
В.П.
Атаманюк3
1ГУ Институт эпидемиологии и инфекционных болезней
им. Л.В. Громашевского НАМН Украины,
Украина;
2ГУ Институт экспериментальной
патологии, онкологии и радиобиологии
им. Р.Е. Кавецкого НАН Украины,
Украина;
3ООО «НПК Экофарм», Украина
ПРОТЕФЛАЗИД:
АНТИРЕТРОВИРУСНАЯ АКТИВНОСТЬ
Аннотация. В
эксперименте на культуре клеток впервые показано специфическое
действие экстракта ПРОТЕФЛАЗИД на
вирус иммунодефицита человека in vitro. Механизм антивирусного
действия обусловлен способностью действующих веществ угнетать активность
обратной транскриптазы. Установленный факт дает основания для дальнейшего
изучения экстракта ПРОТЕФЛАЗИД в отношении специфической анти-ВИЧ активности.
Ключевые слова: екстракт ПРОТЕФЛАЗИД,
специфическое действие, вирус иммунодефицита человека, обратная
транскриптаза.
Одна
из актуальнейших проблем современной медицины связана с ВИЧ-инфекцией, которую
вызывают два лимфотропных вируса –
ВИЧ-1 и ВИЧ-2. Заболеваемость на ВИЧ
постоянно растет, поэтому обеспечение
клинической практики антиретровирусными эффективными препаратами
является важной и актуальной задачей. В настоящее время в лечении инфекций,
вызванных ВИЧ, используют антиретровирусные препараты 3-х классов веществ:
нуклеозидные ингибиторы обратной транскриптазы, ненуклеозидные ингибиторы
обратной транскриптазы и ингибиторы протеазы ВИЧ [1].
В
последнее время установлено, что некоторые флавоноиды обладают антивирусной
активностью по отношению к вирусным инфекциям, имеющим наибольшее значение в
современной медицине. Антивирусная активность обусловлена, как правило,
индукцией α- и ɣ-интерферонов и подавлением ряда специфических
ферментов, задействованных в репликации вирусов в пораженных клетках [2-5].
Флавоноидами
называют группу природных биологически активных соединений - производных
бензопирона, в основе которых лежит фенилпропановый скелет, состоящий из
С6-С3-С6 углеродных единиц с атомом кислорода в гетероциклическом кольце. В
зависимости от степени окисления и гидроксилирования пропанового скелета и
расположения фенильного радикала флавоноиды разделяются на несколько групп: флавоны (хризин,
апигенин), изофлавоны, флавонолы, флавононы и флавононолы.
Флавоноиды широко распространены в растительном
мире. Особенно богаты флавоноидами высшие растения, которые относятся к
розоцветным (боярышник, черноплодная рябина), бобовым (софора японская,
стальник полевой, солодка), гречишным (разные виды горцев - перечный,
почечуйный, птичий, гречка), астровым (бессмертник песчаный, сухоцвет болотный,
пижма), яснотковым (пустырник сердечный) и др. Часто флавоноиды встречаются в
тропических и альпийских растениях. Они выявлены также у низших растений:
зеленые водоросли (ряска), споровые (мхи, папоротники), хвощи (хвощ полевой), а
также у некоторых насекомых (мраморно-белая бабочка). Находятся флавоноиды в
разных органах, но чаще в наземных - цветах, листьях, плодах; гораздо меньше их
в стеблях и корнях (солодка, шлемник байкальский, стальник полевой).
Большой
интерес вызывают исследования, посвященные ингибирующей активности некоторых
флавоноидов при ВИЧ. In vitro было показано, что байкалин ингибирует
репродукцию ВИЧ-1. Доказано, что анти-ВИЧ активность байкалина состоит из
нескольких механизмов. Во-первых - ингибирование первых стадий взаимодействия
вируса и клетки - влияние на CD4 и хемокиновые корецепторы [6], антагонизм к
ВИЧ-1 обратной транскриптазе [7].
Байкалин [8], робистафлавон и гинокифлавон [9] ингибируют активность
ВИЧ-1 обратной транскриптазы, а некоторые катехины ингибируют активность
ДНК-полимераз [10]. Кроме того установлено, что некоторые флавоноиды, в том
числе диметилгардерин А и 3,2'- дигидрооксифлавон, ингибируют ВИЧ-протеиназу
[11]. Робинетин, мирицетин, байкалин, кверцетагенин [12] и кверцетин
3-0-(2'галиоил) α-L-арабинозид [13] ингибируют ВИЧ-интегразу. Установлено
также, что флавоноиды крисин, акацетин и апигенин предотвращают активацию
ВИЧ-инфекции, влияя на транскрипцию вируса [14].
Группой украинских исследователей под эгидой
НПК "Экофарм" (Украина) был разработан экстракт флавоноидов
растительного происхождения, известный под торговым названием
"ПРОТЕФЛАЗИД". В состав экстракта вошли флавоноидные гликозиды,
выделенные из диких злаков Deschampsia
caespitosa L. (Щучка дернистая) и
Calamagrostis epigeios L. (Вейник
наземный). Флавоноид-содержащая фармакологическая композиция имеет достаточно
выраженную активность по отношению к вирусам гриппа, герпеса и гепатита С [15,
16].
ЦЕЛЬ РАБОТЫ: изучить анти-ВИЧ активность экстракта ПРОТЕФЛАЗИД, содержащего
флавоноиды, и определить возможный
механизм его действия.
МАТЕРИАЛЫ И МЕТОДЫ.
Культура клеток. Лимфобластоидные
клетки МТ-4 получены из банка клеток Института экспериментальной патологии,
онкологии и радиобиологии НАН Украины. Питательная среда состояла из 88% среды
RPMI 1640 (Sigma) с добавлением 10% инактивированной прогреванием фетальной
сыворотки теленка (Sigma) и антибиотиков. Клетки выращивали в пластиковых
флаконах (Nunc) объемом 50 мл при 370С и 5% СО2. Каждые
3-4 дня живые клетки подсчитывали с помощью трипанового синего и рассеивали в
начальной концентрации 2,5х105 клеток на 1 мл.
Препараты: ПРОТЕФЛАЗИД - растительный экстракт флавоноидов
спиртовый, жидкий, производства НПК "Экофарм" (Украина). Состав:
флавоноидные гликозиды, выделенные из диких злаков Deschampsia caespitosa L. и Calamagrostis
epigeios L. В 1 мл экстракта содержится: 0,3 мг смеси карбоновых кислот в
пересчете на яблочную кислоту; 0,32 мг флавоноидов в пересчете на рутин;
растворитель экстракции - этиловый спирт.
Препарат
сравнения - "Ретровир" (капсулы, содержащие 250 мг азидотимидина),
лот А03014В, производства "GlaxoSmithKline, Inc." (Великобритания).
Порошок
ретровира извлекали из капсул, растворяли в 2 мл DMSO, доводили до объема 10 мл
средой RPMI 1640, фильтровали через стерилизующие фильтры фирмы
"Millipore" с размером пор 0,22 мкм. На ростовой среде (85% среды
RPMI 1640 и 15% сыворотки эмбриона теленка) готовили рабочие разведения. Начальная концентрация - 100
мМ (25 мкг/мл).
Вирус
иммунодефицита человека (референс-штам ВИЧ-1RF) - в виде
продуцирующей культуры МТ4/ВІІІ ЛБК - Т-лейкоциты человека - продуцента вируса
иммунодефицита I типа, получен из музея вирусов Института вирусологии им. Д. И.
Ивановского (РФ). Вирус хранится при –70 0С.
Источником
ВИЧ служила культуральная среда клеток МТ4/ВІІІ ЛБК. Предварительно было
определено, что инфицированность этих клеток достигала практически 100%, по
данным непрямой иммунофлюоресценции с моноклональными антителами к антигену р24
ВИЧ-1. Тождество вируса, который продуцируется клетками МТ-4/ВІІІ ЛБК, из ВИЧ-1
было подтверждено в реакции нейтрализации.
Реакция нейтрализации. Процедуру нейтрализации осуществляли
таким образом: каждый исследуемый образец, позитивный и негативный к контролю
тест-системы "Genetic SystemsТМ HIV-1 Ag EIA" вносили в 4
пробирки по 150 мкл в каждую, 2 из них маркировали буквой А, другие - буквой В.
В пробирки А вносили по 25 мкл НЖ (надосадочная жидкость), в пробирки с буквой
В - по 25 мкл НК (нейтрализующий компонент). Оставляли на 30 мин. при комнатной
температуре для того, чтобы состоялась нейтрализация антигена р24. Дальнейший
анализ проводили в соответствии с процедурой тестирования на тест-системе
"Genetic SystemsТМ HIV-1 Ag EIA". Верификацию наличия
антигена р24 в исследуемых образцах осуществляли путем сравнения ОП (оптическая
плотность) с нейтрализующим реагентом и ОП образцов, в которые добавляли НК.
Процент нейтрализации рассчитывали за формулой:
ОПср. (образец+НК)-ОПср.(образец+НЖ)
% нейтрализации =
--------------------------------------------------------
ОПср. (образец+НК)-ОПср.НК
Образец считали таким,
который содержит антиген р24 ВИЧ-1, если процент нейтрализации составлял 50 %.
Определение инфекционного титра ВИЧ. Инфекционный титр ВИЧ-1
определяли путем десятикратных разведений вируса, который вносили в лунки
планшета с клетками МТ-4 и культивировали при 370С в течении 5 суток
в атмосфере 5% СО2. Потом из каждой лунки отбирали среду и
определяли наличие в ней антигена р24 ВИЧ-1. Выявление экспрессии белка р24
ВИЧ-1 в отобранных образцах проводили методом ИФА с помощью двух
иммуноферментных тест-систем для выявления антигена р24 ВИЧ: отечественной –
"DIA-HIV-Ag/Ab" производства ЧАО НПК "Диапроф-Мед"
(Украина), которая имеет высокую
чувствительность по антигену р24 ВИЧ (2,5 пкг/мл по международному стандарту
ABI и 0,7 МО по стандарту NIBSC) [17] и тест-системой "Genetic SystemsТМ
HIV-1 Ag EIA" (BioRad, США).
Исследование
антивирусного действия экстракта ПРОТЕФЛАЗИД. Для определения
анти-ВИЧ активности экстракта ПРОТЕФЛАЗИД использовали традиционную модель
первично-инфицированных ВИЧ суспензионных клеток МТ-4. Инфицирование клеток
МТ-4 штаммом ВИЧ-1 проводили путем добавления вируса к клеточной суспензии с
концентрацией 4-5х105 кл/мл и множественностью заражения 100 ІД50/лунку.
Ингибирующий эффект оценивали на 5 сутки культивирования по снижению
инфекционного титра ВИЧ, обработанного экстрактом ПРОТЕФЛАЗИД в разных
концентрациях, по сравнению с контролем вируса. За эффективную ингибирующую
концентрацию ЕС50 принимали такую, в которой препарат уменьшал
инфекционный титр вируса не менее чем на 1,7-2,0 lg IД50.
Определение активности обратной транскриптазы.
Источником обратной транскриптазы (ревертазы) в наших исследованиях был мышиный
ретровирус, продуцируемый клетками NML, предоставленный нам д.б.н. Ю.И.
Кудрявцем (Институт экспериментальной патологии, онкологии и радиобиологии НАН
Украины). Определение обратно-транскриптазной активности проводили
радиометрическим методом по Greenberger et al. [17] по уровню включения 3Н-ТТФ
в кислотонерастворимый продукт на
экзогенной матрице поли рА - олиго дТ в
инкубационной смеси следующего состава: 50 мМ трис-HCl рН 7,8; 60 мМ KCl; 2 мМ
дитиотреитола; 0,25 мМ MnCl2; 0,1%
об/об тритон Х-100; 0,020 мМ ТТФ; 37 кБк 3Н-ТТФ
("Амершам", Англия) (удельная активность 2,37 ТБк/ммоль) и 0,2 ОЕ/мл
матрицы поли рА - (дТ)12. Активность проб определяли на жидкостном
сцинтилляционном счетчике "Intertecheniqe SL30".
Статистическая
обработка результатов исследований. Для установления значимости полученных показателей и определения
достоверности отличий между ними использовано
значение средней арифметической трех повторов показателей ОП образцов,
полученных в ИФА, стандартной погрешности и среднеквадратичного отклонения с
использованием компьютерной программы Microsoft Office Excel 2003.
РЕЗУЛЬТАТЫ
И ОБСУЖДЕНИЕ.
Инфекционный
титра и индекс нейтрализации ВИЧ.
Как показывают данные рис.1, ВИЧ в суспензионных
культурах клеток обнаруживается к разведению 105.
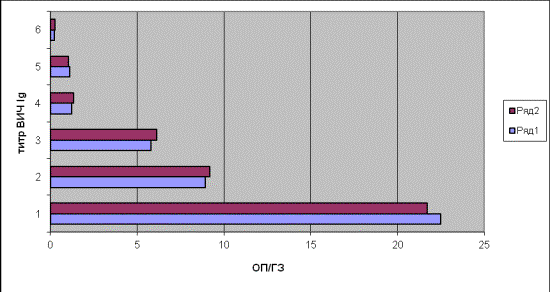
Рис. 1. Определение инфекционного титра
ВИЧ в культуре клеток МТ-4 тест-системами: ряд 1 - DIA-HIV-Аg/Ab и ряд 2 -
Genetic SystemsТМ HIV-1 Ag EIA.
Верификацию наличия
антигена р24 в исследуемых образцах подтверждали с помощью реакции нейтрализации.
Индекс нейтрализации ВИЧ в клетках МТ-4 составлял - 98,4%.
Анти-ВИЧ
активность экстракта ПРОТЕФЛАЗИД в культуре клеток МТ-4. Анти-ВИЧ
активность экстракта ПРОТЕФЛАЗИД изучали в концентрациях: 10,0; 5,0; 2,5; 1,25;
0,64; 0,32; 0,15 мкг/мл. В каждую пробу с культурой вносили вирус
иммунодефицита человека, в дозе 100 ІД50/лунку, культивировали его в течение 5 суток, потом в каждой пробе
определяли инфекционный титр вируса. Исследуемый препарат оставался в среде на
протяжении всего цикла исследования. В качестве референс-препарата использовали ретровир в разведениях 2,5 μМ, 0,25 μМ,
0,025 μМ, что соответствует его
концентрациям: 0,650; 0,065 и 0,0065 мкг/мл, соответственно. Результаты
исследований показаны на рис. 2.
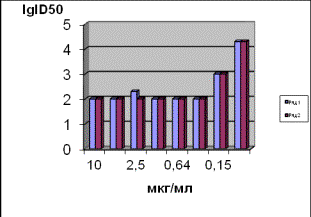
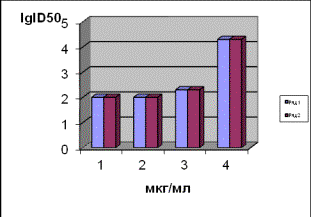
а б
Рис. 2. Результаты определения анти-ВИЧ
активности экстракта ПРОТЕФЛАЗИД: (а) и ретровира (б) тест-системами: ряд 1-
DIA-HIV-Ag/Ab и ряд 2 - Genetic SystemsТМ HIV-1 Ag EIA.
На основании результатов,
приведенных на рис. 2, определенны величины ЕС50 - эффективная
ингибирующая концентрация исследуемого экстракта ПРОТЕФЛАЗИД, которая подавляет
репродукцию ВИЧ не менее как на 1,7-2,0 lg ID50, составляла 0,32
мкг/мл, а препарата сравнения ретровира -
6,5 мкг/мл.
Профилактическое
и лечебное действия экстракта ПРОТЕФЛАЗИД. Следующим этапом
исследований было изучение профилактического и лечебного действия экстракта
ПРОТЕФЛАЗИД. Для этой цели использовали модель продуктивной ВИЧ-инфекции
суспензионной культуры МТ-4. Препарат в эффективной дозе (0,32 мкг/мл) вносили в культуры за 24 часа
до заражения и через 24 часа после заражения ВИЧ-1. Результаты изучения
профилактического и лечебного действия экстракта ПРОТЕФЛАЗИД на репродукцию ВИЧ
в культуре клеток МТ-4 приведены в табл. 1. Выявление ВИЧ в культуре клеток
проводили иммуноферментным методом параллельно на тест-системах «DIA-HIV-Ag/Ab»
и «Genetic SystemsTM HIV-1 Ag EIA».
Таблица 1.
Профилактическое и лечебное действия экстракта ПРОТЕФЛАЗИД на репродукцию ВИЧ в
культуре клеток МТ-4
|
Влияние |
Концен- трация ВИЧ-1 |
ОГ/ГЗ |
Инфекцион-ный
титр, lg ID50 |
Ингиби-ция титра, lg ID50 |
|
|
DIA-HIV-Ag/Ab |
Genetic SystemsTM
HIV-1 Ag EIA |
||||
|
ВИЧ-1 |
10-1 10-3 10-5 10-6 |
21,7±0,651 12,2±0,366 2,63±0,079 0,76±0,023 |
23,2±0,696 16,4±0,492 3,2±0,096 0,68±0,02 |
5,5 |
|
|
Профилактичес-кое использование |
10-1 10-3 |
4,1±0,123 0,34±0,01 |
4,8±0,144 0,56±0,017 |
1,5 |
4,0 |
|
Лечебное использование |
10-1 10-3 |
9,92±0,298 0,49±0,014 |
8,72±0,262 0,51±0,015 |
2,0 |
3,5 |
Анализируя полученные
результаты, следует заметить, что экстракт ПРОТЕФЛАЗИД в дозе 0,32 мкг/мл
подавляет репродукцию ВИЧ при профилактической и лечебной схемах использования
на 4,0 и 3,5 lg ID50, соответственно.
Влияние
экстракта ПРОТЕФЛАЗИД на активность обратной транскриптазы.
Механизмы противовирусного действия флавоноидов требуют дальнейшего изучения с
учетом того, что флавоноиды владеют ингибирующей активностью по отношению к
специфическим вирусным ферментам, в частности ДНК топоизомеразе II, обратной
транскриптазе, ВИЧ-протеиназе и ВИЧ-интегразе. Не исключено, что эти соединения
имеют также и ингибирующую активность по отношению к ферментам, которые
принимают участие в репликации и синтезе ДНК, в том числе провирусной ДНК и
вирусной РНК.
Нами были впервые проведены
исследования по изучению влияния экстракта ПРОТЕФЛАЗИД на активность обратной
транскриптазы в бесклеточной системе. Экстракт ПРОТЕФЛАЗИД добавляли
непосредственно в инкубационную смесь на весь срок инкубации (1 час).
Предварительно готовили разведение исходного препарата 1:10 на ПЕО-400. Для
контроля в пробу добавляли только один растворитель ПЕО-400 без действующих
веществ. Результаты определения активности обратной транскриптазы в присутствии
экстракта флавоноидов и его растворителя приведены в табл. 2.
Таблица 2.
Активность обратной транскриптазы на экзогенной матрице
в присутствии
экстракта ПРОТЕФЛАЗИД
|
Инкубационная смесь |
Добавление 3Н-ТТФ в
ТХУ-нерастворимую фракцию в имп./мин. |
|
Полная (состав инкубационной смеси представлено в
разделе «Материалы и методы») |
65985 |
|
Полная + ПЕО 400 (конечное разведение 1:5) |
40466 |
|
Полная + экстракт ПРОТЕФЛАЗИД (1:10) на ПЕО 400
(конечное разведение препарата 1:50) |
25388 |
|
Полная + экстракт ПРОТЕФЛАЗИД (1:100) на ПЕО 400
(конечное разведение препарата 1:500) |
39257 |
Экстракт ПРОТЕФЛАЗИД в
концентрации около 5,0 мкг/мл вызывает торможение включения 3Н-ТТФ в
ТХУ-нерастворимую фракцию в обратно-транскриптазной реакции на экзогенной
матрице в стандартной системе на 62,7%, по сравнению с активностью фермента,
определяемой в присутствии только одного растворителя ПЕО 400. Экстракт
ПРОТЕФЛАЗИД в концентрации 0,5 мкг/мл не оказывает ингибирующего эффекта.
ВЫВОДЫ.
Экстракт ПРОТЕФЛАЗИД, в
дозе 0,32 мкг/мл (доза в 20 раз меньше препарата сравнения ретровира) в
культуре клеток МТ-4 подавляет репродукцию ВИЧ-1 при профилактической и
лечебной схемах применения на 4.0 и 3.5 lg ID50, соответственно.
Впервые выявленное свойство
экстракта ПРОТЕФЛАЗИД ингибировать обратную транскриптазу может служить одним
из его основных механизмов подавления репродукции ВИЧ в пораженных клетках.
ЛИТЕРАТУРА:
1.
Pokrovsky
V.V. Ermak T.Y., Beljaeva V.V., Yurin O.G. HIV-infection: clinics, diagnostics and treatments. – Мoscow: «Geotar Medic», 2000. – 489 p.
2. Erlich P. The theary and practice of chemotherapy / P.Erlich // Folia
Serologica. – 2011. – № 7. –
P. 697-714.
3. Nijveldt R. J. Van
Nood E., van Hoorn D.E.C. et al. Flavonoids: a review of probable mechanisms of
action and potential applications // Am J Clin Nutr. – 2001. – № 74. – P.
418-425.
4. Brasseur T.
Anti-inflammatory properties of flavonoids. // J. Pharm Belg. – 1989. – V. 44,
№ 3. – Р. 235-341.
5. Liu AL Anti-influenza virus activities of flavonoids from the
medicinal plant Elsholtzia rugulosa / Liu AL, Liu B, Qin HL, Lee SM, Wang YT, Du GH //. Planta Med. – 2008. – Vol.
74(8). – P. 847-51.
6. Li BQ, Fu T, Dongyan Y et al. Flavonoid baicalin inhibits HIV-1 infection at the
level of viral entry. Biochem Biophys Res Commun 2000; 276:534.
7. Li BQ, Fu T, Yan
YD et al. Inhibition of HIV
infection by baicalin — a flavonoid compound purified from Chinese herbal
medicine. Cell Mol Biol Res 1993; 39:119–24.
8. Ono K, Nakane H,
Fukushima M, et al. Inhibition of reverse transcriptase activity by a flavonoid com 354. / Intern. J. of Antimicrobial Agents 26
(2005)343–356
9. Lin YM,
Anderson H, Flavin MT, et al. In vitro anti-HIV activity of biflavonoids
isolated from Rhus succedanea and Garcinia multiflora. J Nat Prod
1997; 60:884–8.
10. Moore PS,
Pizza C. Observations on the inhibition of HIV-1 reverse transcriptase by
catechins. Biochem J 1992; 288:717–9.
11. Brinkworth RI,
Stoermer MJ, Fairlie DP. Flavones are inhibitors of HIV-1 proteinase. Biochem Biophys
Res Commun 1992; 188:631–7.
12. Fesen MR,
Pommier Y, Leteurtre F, Hiroguchi S, Yung J, Kohn KW. Inhibition of HIV-1
integrase by flavones, caffeic acid phenethyl ester (CAPE) and related
compounds. Biochem Pharmacol 1994; 48:595–608.
13. Kim HJ, Woo
ER, Shin CG, Park H. A new flavonol glycoside gallate ester from Acer
okamotoanum and its inhibitory activity against human immunodeficiency
virus-1 (HIV-1) integrase. J Nat Prod 1998;61:145–8.
14. Critchfield
JW, Butera ST, Folks TM. Inhibition of HIV activation in latently infected
cells by flavonoid compounds. AIDS Res Hum Retroviruses 1996; 12:39–46.
15. Choi HJ. Antiviral activity of quercetin 7-rhamnoside against porcine epidemic
diarrhea virus //Choi HJ, Kim JH, Lee CH, Ahn YJ, Song JH, Baek SH, Kwon DH // Antiviral
Res. – 2009. – Vol. 81(1). – P. 77-81.
16. Rybalko S.L., Djadun S.T., Rudenko A.O. Proteflazid. –Kyiv, 2002. – 69 p.
17. Greenberger
JS, Rosenthal DS, Aaronson SA, Moloney WC. Acute myelogenous leukemia of the
Wistar/Furth rat: establishment of a continuous tissue culture line producing
lysozyme in vitro and in vivo. Blood. 1975; 46(1): 27-38.