Ренева Л.В.¹, Волкова Л.В ²¹
-
ФГУП НПО «Микроген» Минздрава России в г. Пермь «Пермское НПО «Биомед»; ²-
Пермский национальный исследовательский политехнический университет, кафедра
химии и биотехнологии, Россия.
ОЦЕНКА АНТИТЕЛООБРАЗОВАНИЯ У АКТИВНЫХ ДОНОРОВ ПЛАЗМЫ ДЛЯ
ФРАКЦИОНИРОВАНИЯ ИММУНИЗИРОВАНННЫХ ВАКЦИНОЙ ПРОТИВ ГЕПАТИТА В.
В настоящее время вирусный гепатит В
(ВГВ), наряду с гепатитом С и ВИЧ является
одними из самых распространенных вирусных заболеваний, опасность которого обусловлена
не только развитием острого инфекционного процесса с наличием тяжелых и особо
тяжелых форм, но и распространением врожденной инфекции, формированием пожизненного
вирусоносительства, хронизацией процесса с частым развитием весьма отдаленных
тяжелых последствий. Ежегодно в мире выявляется около 50 млн. больных острой
формой ВГВ, в России регистрируется свыше 50 тысяч новых случаев заболевания,
свыше 5 миллионов человек являются хроническими носителями ВГВ, которые
клинически проявляются через 10–15 лет после инфицирования. Опасность и широкая
распространенность ВГВ связаны с тем, что из общего числа первично
инфицированных 2–10% заболевших взрослых становятся хроническими больными или
носителями ВГВ. При этом в детском возрасте хроническая инфекция ВГВ
развивается намного чаще [1]. Рост хронизации до 93% с последующими
осложнениями у больных ВГВ-инфекцией отмечается при суперинфекции гепатита D [4].
Реактивация хронического гепатита В в особо тяжелой форме наблюдается у 14%
больных и отличается высокой (30%) летальностью [11]. В последующие годы при
хронической инфекции у 20% больных развивается цирроз печени и в 30% случаев –
первичный рак печени [10]. Ежегодно от острого и хронического гепатита В и его
последствий в мире умирает 1,6–2,0 млн. человек, из них около 700 тыс. – от
цирроза и 300–500 тыс. – от карциномы печени [5,8]. Учитывая актуальность
данной проблемы постановлением Правительства Российской Федерации № 715 от
01.12.2004 г. вирусный гепатит В включен в перечень социально-значимых
заболеваний.
На
сегодняшний день одним из основных средств терапии острого ВГВ является специфический
иммуноглобулин человека, содержащий антитела к вирусу гепатита В и
предназначенный для внутримышечного или внутривенного введения [3]. Иммуноглобулин с высокими титрами специфических
антител (более 10 МЕ/мл) используют для экстренной профилактики ВГВ.
Своевременное применение данного иммуноглобулина позволяет снизить
заболеваемость более чем в 6 раз. В случае развития заболевания, применение
специфического иммуноглобулина снижает риск осложнений в виде хронизации
процесса и летальности. Потребности отечественного здравоохранения в препаратах
плазмы крови, в том числе
иммуноглобулина против ВГВ, удовлетворены далеко не полностью по причине
недостатка плазмы для фракционирования [9], поскольку положение с донорством в
России остается весьма сложным [7]. Производство иммуноглобулинов против ВГВ
затруднено наличием большого количества противопоказаний к донорству, как
следствие снижения числа доноров [6], недостаточностью иммунных доноров, а так же низким содержанием
уровня антител в крови иммунизированных доноров, снижением их в процессе
донаций крови и плазмы.
Целью
настоящей работы явилась оценка специфической активности антител, длительности
и напряженности пост вакцинального иммунитета
к ВГВ у активных доноров, плазма которых используется в технологии
производства иммуноглобулина против гепатита В.
Объектом
исследования явились доноры плазмы для фракционирования, в возрасте от 18 до 60
лет. Плазма заготавливалась методом дискретного и автоматического афереза [2]. Для
качественного (HBsAg)
и количественного (анти-HBs антитела) определения маркеров ВГВ использовали
твердофазный иммуноферментный анализ и тест-системы, разрешенные к
использованию в лабораторной практике Приказом № 322 Минздравмедпрома РФ от
21.10.2002 г. Для скринингового определения HBsAg
использовали отечественные диагностические тест-системы: «ДС-ИФА-НВsAg», «ДС-ИФА-НВsAg 0,01» («Диагностичесие
системы», г. Нижний Новгород), минимальная концентрация HBsAg составляла 0,01 г/мл.
Данные тест-системы наряду с «дикими» типами
выявляла и мутантные варианты HBsAg. Положительные результаты скринингового исследования HBsAg подтверждали с
использованием конкурентных тест-систем «ИФА-НВsАg-подтверждающий
тест» («Диагностичесие системы», г. Нижний Новгород). Для количественного
определения концентраций анти-HBs
антител использовали отечественные диагностические тест-системы, «МикрАТ-HBs», ФГУП «НПО «Микроген», г. Н.
Новгород.
По результатам предвакцинального скрининга для проведения
вакцинации было отобрано 962 донора. Проведение вакцинации сочеталось с
процедурой плазмафереза в среднем 11±9 донаций плазмы в год.
Для иммунизации доноров использовали
вакцину против гепатита В «Engerix B–1,0»
(Бельгия) и вакцину гепатита В рекомбинантную дрожжевую, суспензию для
внутримышечного введения (ЗАО НПК «Комбиотех» г. Москва).
Вакцинацию проводили по
двум основным схемам:
1.
Стандартная (931 человек) – две первые прививки проводили с интервалом через 1,
третью через 6 месяцев. Схему вакцинации обозначали 0–1–6 мес.
2.
Экстренная (31 человек) – вторую и
третью прививки проводили с интервалом 1 месяц. По этой схеме проводили
ревакцинацию через 12 месяцев после последнего введения вакцины. Схему
вакцинации обозначали 0–1–2–12 мес. Группа
подлежащих бустер-вакцинации составила 27 человек.
Уровень пост вакцинальных антител контролировали при каждой донации.
Активность специфического гуморального иммунитета доноров оценивали в динамике
на протяжении всего периода сохранения титра антител методом ИФА с
использованием тест-системы, «МикрАТ-HBs», Филиала
ФГУП «НПО «Микроген», г. Н. Новгород.
Для оценки напряженности гуморального
иммунитета выбраны следующие диапазоны концентраций анти-HBs
антител:
низкий уровень – до 0,1 МЕ/мл; средний уровень – от 0,1 до 1,0 МЕ/мл; высокий уровень –1,0 до 10,0 МЕ/мл, очень
высокий уровень – 10,0 МЕ/мл и более. При лабораторном тестировании
поствакцинального иммунитета определяли средние геометрические титры анти-HBs
антител и процент сывороток с высокой (1,0-10,0 МЕ/мл) и очень высокой – более
10,0 МЕ/мл уровнем сероконверсии.
Статистическую обработку
результатов исследования проводили с использованием пакета прикладных
программ «Statistica 6,0». Достоверность различий между полученными
показателями в сравниваемых группах оценивали, используя t-критерий Стьюдента.
Проведено предвакцинальное обследование 27883 доноров плазмы
в возрасте от 18 до 60 лет, обратившихся в донорский пункт Филиала ФГУП НПО
«Микроген» в г. Пермь «НПО «Биомед» в период с 2008–2012 гг. По результатам
предвакцинального скрининга для проведения вакцинации отобрано 962 донора в
возрасте от 26 до 56 лет, из них 47% составляли мужчины и 53% женщины, доноров
крови 64%, доноров плазмы 36%.
Установлено, что среднегеометрическая концентрация антител в группе
вакцинированных по стандартной схеме через 1 мес. после завершенного курса
вакцинации составила 5,6±0,1 МЕ/мл, а уровень сероконверсии - 98 %. В структуре этой группы наибольший
удельный вес (53,4%) составили лица
с высокими (1,0-10,0 МЕ/мл) концентрациями антител, с
очень высокими составили 34,6%, что свидетельствовало
о высокой иммуногенности вакцины.
В последующем
отмечали изменение уровня антител в группе привитых
по стандартной схеме.
Число вакцинированных лиц с высоким уровнем антител к HBsAg снизилось начиная с 3 месяца после
завершенного курса вакцинации, а с наличием низкого и среднего уровня анти-HBs
антител, наоборот, возрастало. У вакцинированных по стандартной схеме отмечали
статистически значимое снижение антител в динамике наблюдения: 3
мес.-5,9 МЕ/мл; 6 мес. – от 3,8 МЕ/мл до 1,8 МЕ/мл; 12 мес. - 1,4 МЕ/мл;
24 мес .- 0,6 МЕ/мл; 36 мес. – 0,6 МЕ/мл; 48 мес.- 0,1 МЕ/мл в зависимости от срока после полного курса иммунизации
Удельный вес
лиц, имеющих высокий и очень высокий титр антител к вирусу гепатита В через 3
месяца составил 68 %; через 6 месяцев 60,1%; через 1 год – 55 %; В результате
проведенных исследований установлено, что только 47,3 % вакцинированных
по стандартной схеме доноров сохраняли высокий титр специфических антител через
2 года после проведенной иммунизации; 27,9 % сохраняли высокий
титр специфических антител через 3 года
и только 25 % сохраняли высокий титр
специфических антител через 4 года после
окончания цикла вакцинации (рис. 1).
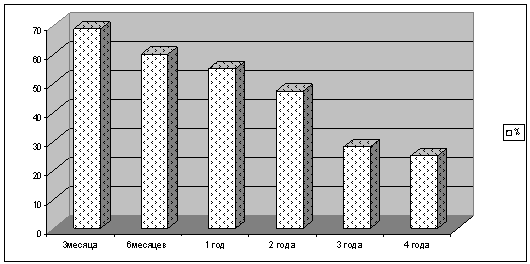
Рис. 1 Динамика
сохранения титра антител к гепатиту В, у доноров иммунизированных по
стандартной схеме вакцинации.
Таким образом, выявлено снижение напряженности
поствакцинального иммунитета в течение времени среди иммунизированных доноров по
стандартной схеме вакцинации.
Следующим этапом
исследования явилась оценка влияния возраста и пола иммунизированных доноров на выработку антител к вирусу
гепатита В (рис. 2).
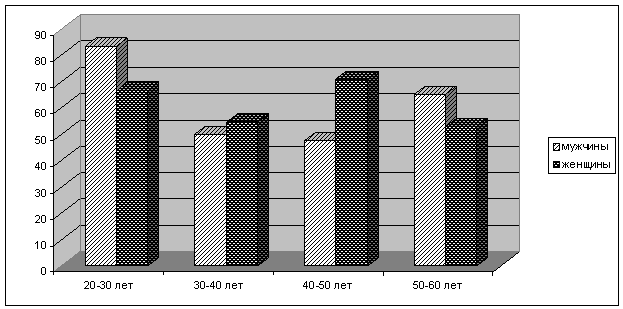
Рис. 2 Уровень иммуноактивных
доноров в различных группах вакцинированных по профилактической схеме.
Результаты анализа
эффективности вакцинации доноров различных возрастных групп, свидетельствовали,
о выработке самого высокого уровня антител у мужчин в возрасте 20–30 лет - 83,4
%, у женщин данного возраста - 66,7%. Среди
женщин 40-50 лет удельный вес лиц, имеющих высокий титр антител, составил
71 %.
Нами проведены
исследования по изучению влияния групповой принадлежности крови иммунизированных
на выработку антител к ВГВ. Анализ, полученных результатов, показал, что
наиболее выраженный иммунный ответ на вакцинацию отмечался у мужчин имеющих первую группу крови и у женщин с
четвертой группой крови. Наименьший иммунный ответ наблюдался у мужчин с третьей
группой крови.
Изучение уровня антител против ВГВ, при использовании
экстренной схемы введения вакцины, показало, что среди привитых (30 человек) после цикла вакцинации состоящего из
трех прививок проводимых через месяц, уровень
сероконверсии составил 82,0 %. Среди
них 62,3 % составили лица со средним (0,1–1,0 МЕ/мл) уровнем поствакцинальных антител, 11,6 %
имели высокий (1,0-10,0 МЕ/мл) и только 1,4% доноров имели очень высокий (10,0 и более) титр антител. Низкий уровень
антител (0,01-0,1 МЕ/мл) имели 27 %
доноров а 2,0 % не дали ответ на проведенную вакцинацию. Экстренная схема
вакцинации от ВГВ, предусматривает
проведение ревакцинации (бустер-вакцинации), через год после окончания
цикла вакцинации. Группа подлежащих
бустер-вакцинации составила 27 человек. После её проведения отмечали увеличение
специфической активности у 96,3% вакцинированных. Из них 10,5 % составили лица со средним уровнем поствакцинальных антител (0,1–1,0 МЕ/мл) ,
47,4 % имели высокий (1,0-10,0 МЕ/мл), 38,6 % доноров очень высокий титр поствакцинальных антител
(10,0 МЕ/мл и более). Низкий уровень антител (0,01-0,1 МЕ/мл), после бустер-вакцинации имели 3,5 % доноров. Таким
образом, проводимая через год после окончания вакцинации по экстренной схеме,
бустер вакцинация привела к выраженному, но не продолжительному иммунному
ответу у 86% вакцинированных.
Было отмечено ежегодное, статистически
значимое снижение средних
геометрических титров анти-HBs
антител в динамике у доноров вакцинированных по экстренной схеме (3 месяца, 6
месяцев,1 год, 2 года, 3 года 4 года) 2,2 МЕ/мл 1,2 МЕ/мл, 60 МЕ/мл, 0,4 МЕ/мл,
0,1 МЕ/мл, 0,1 МЕ/мл. Удельный вес лиц вакцинированных по
экстренной схеме и имеющих высокий и очень высокий уровни антител к ВГВ через 3
месяца после бустер вакцинации составил
62 %; через 6 месяцев 34,1 %; через 1 год он
снизился до 23,5 %.
Анализ сохранения специфических антител к ВГВ у лиц вакцинированных по
экстренной схеме показал, что через 4 года отмечено преобладание удельного веса лиц с низким (0,01–0,1 МЕ/л) уровнем
поствакцинальных антител - 93,6 %, плазму которых нельзя использовать для производства
иммуноглобулина против гепатита В.
При
сравнении концентраций антител к HBsAg у вакцинированных
по экстренной схеме отмечено статистически
значимое снижение удельного веса лиц со средней, высокой и очень
высокой концентрацией антител. Установлено,
что только 37,3 % вакцинированных по экстренной схеме доноров сохраняли
высокий титр специфических антител через 2 года после проведенной иммунизации; 18,6 %
сохраняли высокий титр специфических антител через 3 года и только 12,4 % сохраняли высокий титр специфических
антител через 4 года после окончания
цикла вакцинации.
Оценка динамики изменения концентрации анти-HBs антител у доноров при вакцинации по
стандартной и экстренной схемам показала, что среди
вакцинированных по обеим схемам, выявлено увеличение удельного веса лиц
с отсутствием высокого и очень высокого уровней антител и уменьшением доли лиц
с высокими титрами антител в течении времени прошедшего от момента вакцинации.
Показатели эффективности вакцинации у лиц, иммунизированных по
стандартной схеме были достоверно выше, чем у иммунизированных по экстренной схеме, что определялось,
по-видимому, большим интервалом между второй и третьей вакцинациями, а также особенностью течения процесса специфического
антителообразования, характеризующегося медленным нарастанием концентраций
антител в ответ на введение рекомбинантного HBsAg. (рис 3).
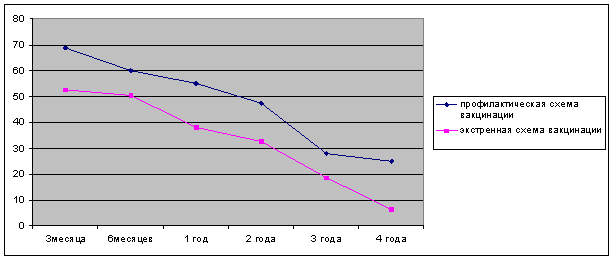
Рис. 3 Динамика
сохранения высоких показателей анти-HBs антител
у доноров при использовании стандартной и экстренной схем иммунизации.
По результатам сравнительных наблюдений, показано, что через 4 года уже
75,0 % вакцинированных по стандартной схеме и 93,6 %, вакцинированных по экстренной схеме не имели необходимого
титра антител (более 1,0 МЕ/мл), плазма этих доноров не могла быть использована для производства
иммуноглобулина против ВГВ.
В целом тенденция снижения уровня антителопродукции значительно
выражена в группе привитых по экстренной схеме, что подтверждает вывод о
необходимости введения через год дополнительной бустерной дозы вакцины
иммунизированным по схеме 0–1–2 месяцев. Кроме того, отмечено ежегодное,
статистически значимое снижение средних
геометрических титров анти-HBs антител в
динамике наблюдения (3 месяца, 6 месяцев,1 год, 2 года, 3 года 4 года), что
составляло по стандартной схеме вакцинации 5,9 МЕ/мл, 3,8 МЕм/л – 1,8 МЕм/л, 1,4
МЕ/мл, 0,6 МЕ/мл, 0,1 МЕ/мл против 2,2 МЕ/мл 1,2 МЕ/мл, 0,6 МЕ/мл, 0,4 МЕ/мл, 0,1
МЕ/мл, 0,1 МЕ/мл – по экстренной. Таким образом, наблюдалось ежегодное падение
уровня антител при использовании обеих схем вакцинации против ВГВ.
Заключение
Экстренная
схема вакцинации от ВГВ создает более низкий и менее продолжительный уровень
поствакцинальных антител у большей части иммунизированных доноров по сравнению
со стандартной схемой вакцинации.
Применение
профилактической схемы вакцинации позволяет получить более выраженный иммунный
ответ на вакцинацию особенно у мужчин и женщин, имеющих первую группу крови в
возрасте от 20 до 30 лет и у женщин с четвертой группой крови в возрасте 40-50
лет. Мужчины, имеющие третью группу крови в возрасте 40-50 лет дают наименьший
по выраженности и продолжительности иммунный ответ.
Установлено, что через три года после проведенной вакцинации
с использованием профилактической схемы, количество доноров имеющих высокий
титр противогепатитных антител снизилось
более чем в 2 раза, в связи с чем
возникает вопрос о необходимости проведения в дальнейшем ревакцинации доноров с
низким уровнем анти-HBs антител для получения высокотитровой плазмы необходимой
для производства специфического иммуноглобулина.
Список
литературы
1. Аммосов А.Д. Гепатит В.
Новосибирск - 2000. – 132с.
2.
Волкова Л.В., Ренева Л.В., Орлова Е.В. Внедрение в практику работы донорского
пункта Пермского НПО «Биомед» аппарата «Autofheresis-C»
для получения иммунной донорской плазмы,
используемой в производстве иммуноглобулинов // Пермский медицинский журнал.- 2010.-
№3.-С.57-61.
3. Воробьева
Н.Н., Казьянин А.В., Борисова В.Н., Мышкина О.К.,
Рысинская Т.К., Николаева А.М., Дедова О.К. Эффективность специфического
иммуноглобулина (Антигеп) при остром вирусном гепатите В //Эпидемиология и
вакцинопрофилактика. - 2004. - № 2 (15). - С.13-16.
4. Горбарец И.П., Яшина Т.Л. и
др. Отдаленные исходы острых вирусных гепатитов В, С и D. // Тез. докл. конференции 20–22 июня 1995 г. «Гепатит В,
C и D – проблемы изучения, диагностики, лечения, профилактики». Москва-1995.
5.
Львов Д.К. Вирусные гепатиты от А до G и далее//Микробиология.- 1997.- № 1. С.70–77.
6.
Ренева Л.В., Волкова Л.В., Орлова Е.В., Казьянин А.В. Мониторинг
донорских кадров – основной способ изучения социального портрета доноров //
Вестник службы крови России . –2012. -
№3. – С. 12 – 17.
7. Селиванов Е.А.,
Данилова Т.Н. Настоящее и будущее службы крови России // Проблемы гематологии и
переливания крови,- 2005.- №3.- С.55-59.
8. Соринсон С.Н.
Вирусные гепатиты А,В,С,D,E, ни-А-Е в клинической практике.- Санкт-Петербург:
Теза.1996 г.
9. Тхай С.В., Захаров
В.В. и др. Пути решения проблемы обеспечения Российского производства
препаратов крови плазмой для фракционирования //Вестник службы крови России.- 2012.-№ 1.-С.44-48.
10.
Dego S.F., Benhamon J.P. Histoire naturelle et traitement des hepatitis virales
chroniques: Une vue d’ensemble. Eurobiologiste (1995) 29.- № 216.-Р.
63–65.
11.
Tanno H. et al. Спонтанная реактивация хронического гепатита В.
Bienn. Sci. Meet. and Postgrad. Course, Brighton, June 3–6.-
1992: Int. Assoc. Study Liver. Brighton 1992, p.177.